下列离子方程式不正确的是
| A.碳酸氢钙溶液跟盐酸反应:Ca(HC03)2+2H+=Ca2++2H20+2C02↑ |
| B.碘化钾溶液跟适量溴水反应:2I一+Br2=I2+2Br— |
| C.将金属锂加入水中:2Li+2H20=2Li++20H一+H2↑ |
| D.将氯气通人氯化亚铁溶液中2Fe2++C12=2Fe3++2Cl一 |
已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+ H2O 2H++ 2CrO42-(黄色)
2H++ 2CrO42-(黄色)
①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。
②向2 mL 0.1 mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72-+ 14H++ 6Fe2+ 2Cr3+(绿色) + 6Fe3++ 7H2O。下列分析正确的是
2Cr3+(绿色) + 6Fe3++ 7H2O。下列分析正确的是
| A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |
| B.实验②能说明氧化性:Cr2O72- > Fe3+ |
| C.CrO42- 和Fe2+在酸性溶液中可以大量共存 |
| D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)  2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是
A.反应②中的能量变化如图所示,则ΔH2=E1-E3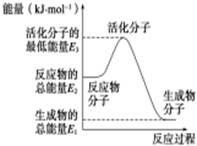 |
| B.H2的燃烧热为241.8 kJ·mol-1 |
| C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
| D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1 |
下列排列顺序完全正确的组合是
①溶解性:Na2CO3>NaHCO3>MgCO3>Mg(OH)2
②等浓度的下列盐溶液的pH关系:NaAlO2>NaHCO3>NaClO
③常温下,以a1、a2、a3分别表示pH=2的盐酸、pH=12的氨水、pH=12的碳酸钠溶液中水的电离程度,则a1=a2>a3
④同温下,1L0.5mol/LNH4Cl溶液中n(NH4+)与2L 0.25mol/LNH4Cl溶液中n(NH4+),分别为a、b,则a>b
⑤热稳定性:H2O>H2Se>H2S
⑥半径:Cl->O2->Al3+;F<Si<Na
⑦氧化性:MnO2>Cl2>Fe3+>Cu2+
⑧沸点:金刚石>氯化钠>干冰>冰醋酸
| A.①②③④⑥ | B.①③④⑥⑦⑧ | C.②⑤⑧ | D.①④⑥⑦ |
NA表示阿伏加德罗常数,下列说法中正确的是
①等物质的量的N2和CO所含分子数均为NA
②常温下,4g CH4含有NA个C-H共价键
③1 mol Na2O2与水完全反应时转移电子数为2NA
④将NA个NH3分子溶于1 L水中得到1 mol·L-1的氨水
⑤25 ℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01NA
⑥1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
| A.①③⑤ | B.②⑤ | C.②④⑥ | D.②③⑤ |
常温下,下列各组离子在指定溶液中一定能大量共存的是
①0.1 mol·L-1NaAlO2溶液:H+、Na+、Cl-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-、NO3-
⑤使甲基橙变黄的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、Cl-、S2-
| A.①③⑤ | B.②④ | C.②⑤⑥ | D.④⑤ |