某些化学反应可用下式表示 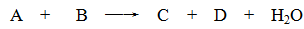
请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式: 。
(2)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
(3)若A、C均含有铝元素。①当B是盐酸时,C是 ;②当B是NaOH时,C是 。
化学反应的限度是当___和__相等,反应物和生成物的__保持不变时,所达到的一种看似的“平衡状态”。
用电子式表示:
CaCl2的形成过程______NaOH的电子式___ Cl2 的电子 式___
式___
下列反应中,属于放热反应的是。
① 煅烧石灰石(主要成分是CaCO3)制生石灰(CaO) ② 燃烧木炭取暖③生石灰与水反应 ④ 酸与碱的中和反应⑤ 氢气还原氧化铜 ⑥ 炽热的铁粉与水蒸气的反应
原电池是把转化成___的装置,其反应的实质是_。
写出铜锌原电池(稀硫酸为介质)的电极反应:
正极,负极。
在第3周期中,化学性质最稳定的元素符号是,最高价氧化物的水化物的酸性最强的化合物的化学式是,碱性最强的化合物的化学式是,显两性的氢氧化物的化学式是,该两性氢氧化物与氢氧化钠溶液反应的离子方程式为。