一密闭容器中充入1 mol N2和3 mol H2,在一定条件下反应。下列有关说法正确的是
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,正反应和逆反应的速率都为零 |
| D.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
设反应C+CO2 2CO(正反应吸热)反应速率为v1,N2+3H2
2CO(正反应吸热)反应速率为v1,N2+3H2 2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1、v2的变化情况为
2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1、v2的变化情况为
| A.同时增大 | B.同时减小 |
| C.v1增大,v2减小 | D.v1减小,v2增大 |
Na2S2O3溶液跟稀H2SO4反应的化学方程式为: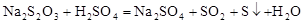 。下列各组实验中,溶液中最先变浑浊的是
。下列各组实验中,溶液中最先变浑浊的是
| 反应 |
反应物 |
H2O |
||||
| 温度 |
Na2S2O3 |
H2SO4 |
V |
|||
| ℃ |
v(mL) |
c(mol×L-1) |
v(mL) |
c(mol×L-1) |
(mL) |
|
| A |
10 |
5 |
0.1 |
10 |
0.1 |
5] |
| B |
10 |
5 |
0.1 |
5 |
0.1 |
10 |
| C |
30 |
5 |
0.1 |
5 |
0.1 |
10 |
能提高单位体积内活化分子数,但不改变活化分子百分数的是
| A.增大反应物的浓度 | B.增大气体压强 |
| C.升温 | D.使用催化剂 |
强酸与强碱稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①浓硫酸 ②稀硝酸,恰好完全反应的热效应依次为ΔH1、ΔH2,则二者的关系正确的是
| A.ΔH1=ΔH2 | B.ΔH1>ΔH2 |
| C.ΔH2>ΔH1 | D.无法比较 |
在25℃、1.01×105Pa时,1gCH4燃烧时生成CO2与液态H2O,放出55.6kJ的热量,则CH4的燃烧热为
| A.55.6kJ/mol | B.889.6kJ/mol | C.-889.6kJ/mol | D.444.8kJ/mol |