桂醛在食品、医药、化工等方面都有应用。肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.
(1)肉桂醛由C、H、O三种元素组成,质谱分析肉桂醛分子的相对分子质量为132,其分子中碳元素的质量分数为81.8%,肉桂醛的分子式是 。
肉桂醛是苯的一取代物,核磁共振氢谱显示,苯环侧链上有三种不同化学环境的氢原子,其结构简式是 。(不考虑顺反异构与对映异构)
(2)已知:
I.醛与醛能发生反应,原理如下:
II.合成肉桂醛的工业流程如下图所示,其中甲为某种烃。
①甲的结构简式是 。
②丙和丁生成肉桂的化学方程式是 。
(3)肉桂醛能被银氨溶液氧化,再经酸化得到肉桂酸,写出肉桂酸甲酯的结构简式 。
(4)现用芳香烃A为原料合成肉桂酸甲酯H的路线如下,测出A的核磁共振氢谱谱图有6个峰,其面积之比为1︰2︰2︰2︰1︰2。:
①化合物F中的官能团有 (填名称)。
②B→C的反应类型是 ,F→G的反应类型是 ,
③书写化学方程式
F→I
G→H
④G的同分异构体中,属于酯类目苯环上只有一个取代基的同分异构体有 种。
其结构简式分别是
下表是A、B、C、D、E五种有机物的有关信息:
| A |
①能使溴的四氯化碳溶液褪色; ②比例模型为 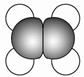 ③能与水在一定条件下反应生成C |
| B |
①由C、H两种元素组成。 ②球棍模型为 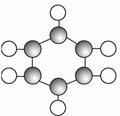 |
| C |
①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D |
①相对分子质量比C少2; ②能由C催化氧化得到 |
| E |
①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
回答下列问题:
(1)A~E中,属于烃的是___________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为_______________。
(3)C催化氧化生成D的化学方程式为_________________________________。
(4)有机物B具有的性质是__________ (填序号)。
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是________________________(用化学方程式说明)。
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):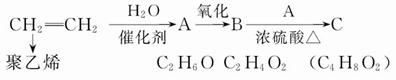
请回答下列问题:
(1)A物质的化学名称是____________________________________________;
(2)B和A反应生成C的化学方程式为________________________________,
该反应的类型为__________________________________________________;
(3)写出乙烯生成聚乙烯的化学方程式为_____________________________,
该反应的单体为____________,链节为___________,聚合度为__________。
甲苯是对煤的综合利用得到的产物之一,其结构简式为 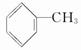 。试回答下列问题:
。试回答下列问题:
(1)苯与甲苯的相互关系为_________。
| A.同分异构体 | B.同位素 |
| C.同素异形体 | D.同系物 |
(2)甲苯燃烧时的现象为________________________,1 mol甲苯完全燃烧消耗氧气的物质的量为________。
(3)甲苯苯环上的一氯代物有________种。
(4)已知具有 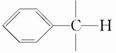 结构的物质可被酸性高锰酸钾氧化。区分苯和甲苯的方法是________。
结构的物质可被酸性高锰酸钾氧化。区分苯和甲苯的方法是________。
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 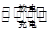 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol 电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol 电子时铁电极的质量减少11.2 g。请回答下列问题。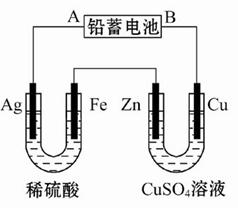
(1)A是铅蓄电池的极,铅蓄电池正极反应式为,放电过程中电解液的密度(填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是,该电极的电极产物共g。
(3)Cu电极的电极反应式是,CuSO4溶液的浓度(填“减小”、“增大”或“不变”)。
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示。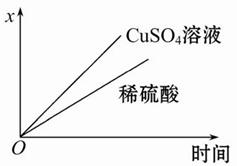
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
请分析下列有关铝盐溶液电解时的变化情况。
(1)用石墨作电极,用如图装置电解AlCl3溶液,两极均产生气泡,阴极区有沉淀生成。持续电解,在阴极附近的溶液中还可观察到的现象是,解释此现象的离子方程式是。
(2)若用石墨作电极电解NaCl和Al2(SO4)3的混合溶液,混合溶液中二者的物质的量浓度分别为3 mol·L-1、0.5 mol·L-1,则下列表示电解过程的曲线正确的是。