氮可以形成多种离子,如N3-、N3-、NH2-、NH4+、N2H5+、N2H62+等,已知N2H5+与N2H62+是由中性分子X结合H+形成的,有类似于NH4+的性质。
⑴ 1个N3-离子含有 个电子;
⑵ 形成N2H5+离子的中性分子X的分子式是 ;
X在氧气中可以燃烧,写出燃烧反应的化学方程式 ;
⑶ 写出N2H62+离子在强碱溶液中反应的离子方程式 。
气态可逆反应:mA(g)+nB(g) pC (g)+qD(g),符合下图。试用“>”或“<”填(1)~(3)题。
pC (g)+qD(g),符合下图。试用“>”或“<”填(1)~(3)题。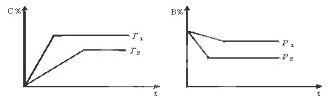
(1)温度T1___________T2,
(2)压强p1___________ p2,
(3)m+n____________ p+q,
(4)正反应为___________反应(填“放热”或“吸热”)。
25℃、101kPa时,一些物质的燃烧热为:
| 化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
| △H/( kJ•mol-1) |
-283.0 |
-285.8 |
-726.5 |
请回答下列问题:
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:_____________________;
(2)根据盖斯定律完成反应的热化学方程式:CO(g)+2H2(g)═CH3OH(l)△H=_____________。
(原创)NH3是一种重要的化工产品,可用于生产尿素 [CO(NH2)2]、处理烟气等。
Ⅰ.工业上合成尿素的反应:
2NH3(g)+CO2(g) CO(NH2)2 (l) + H2O (g) ΔH
CO(NH2)2 (l) + H2O (g) ΔH
(1) 已知合成尿素的反应分两步进行:
2NH3(g)+CO2(g) NH2COONH4(s) ΔH1
NH2COONH4(s) ΔH1
NH2COONH4(s)  CO(NH2)2(l)+ H2O (g) ΔH2
CO(NH2)2(l)+ H2O (g) ΔH2
其能量变化曲线如图1所示,则△H、△H1和△H2由小到大的顺序为__________。
图1图2
(2) 某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g)  CO(NH2)2 (l) + H2O (g) ,反应过程中混合气体中NH3的体积分数如图2所示。
CO(NH2)2 (l) + H2O (g) ,反应过程中混合气体中NH3的体积分数如图2所示。
①A点的逆反应速率v逆(CO2)______B点的正反应速率v正(CO2)。 (填“>”、“<”或“=”)
②下列能说明该反应达到平衡状态的是________________(填代号)。
a. NH3、CO2、H2O的分子数之比为2:1:1b.体系的压强保持不变
c.单位时间内消耗1mol CO2同时生成2mol NH3 d.2v正(NH3) =v逆(H2O)
③对于有气体参与的反应,平衡常数Kp可用气体组分(B)的平衡分压p(B)代替该气体的物质的量浓度c(B)。实验测得体系平衡时的压强为10MPa,列式计算该反应的平衡常数Kp=_______ (提示:写出Kp的表达式再代入数据进行计算,分压=总压×体积分数)。
④L(L1、L2),X可分别代表压强或温度。右图表示L一定时,该反应CO2 (g)的平衡转化率随X的变化关系。
X代表的物理量为__________。判断L1、L2的大小关系,并简述理由: 。
Ⅱ.烟气中的NOx必须脱除(即脱硝)后才能排放:
(3)下图是一种用NH3脱除烟气中 NO的原理。该脱硝反应中,氧化剂是 (填化学式) 。
(4)利用反应8NH3+6NO2═7N2+12H2O构成原电池,也能消除烟气的排放,同时还能充分利用化学能,装置如图所示。则电极b为______极;a电极的电极反应式为 。
(原创)结合下表回答下列问题(均为25℃时的数据)
(1)上述五种酸中,酸性最强的是 (填化学式)。HCO3-的电离平衡常数表达式K= 。
(2)已知硼酸(H3BO3)与足量NaOH溶液发生酸碱中和反应的离子方程式为: HBO3+ OH-=B(OH)4-,则硼酸为 元酸,硼酸的电离方程式为 。
(3)常温下,0.01 mol·L-1的HNO2溶液加水稀释的过程中,下列各项数据增大的是 (填代号)。
①c(H+ ) ②c(NO2- )/ c(H+) ③Ka(HNO2)
④c(H+ )/ c(HNO2) ⑤c(OH-) ⑥ 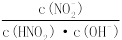
(4)右图描述的是醋酸与HNO2在水中的电离度与浓度关系,其中反映醋酸的是曲线 (填“甲”或“乙”,已知:电离度=已电离的溶质分子数/原有溶质分子总数) 。
(5)根据表中提供的数据可知,在溶液中能大量共存的微粒组是 (填代号)。
(6)设计一个现象明显、操作简便的实验方案证明HNO2酸性强于碳酸(不用叙述仪器和具体操作)___________________ 。
(原创)I.现有以下物质:①铁 ②稀硝酸 ③明矾 ④液氨 ⑤冰醋酸 ⑥蔗糖溶液 ⑦无水乙醇 ⑧熔融态的氢氧化钠⑨硫酸钡晶体 ⑩三氧化硫气体,回答下列问题(用相应物质序号填写):
(1)可以导电的有 。(2)属于强电解质的有 。
II. A、B、C、D四种溶液分别是氢氧化钡溶液、氨水、醋酸溶液、盐酸中的一种。
已知同浓度的四种溶液:①加入大小完全相同的锌粒,仅A、C中放出气体,且开始时A中冒气泡的速度快;②相同条件下,取B、D溶液进行导电性实验,发现导电能力最差的是D。回答下列问题:
(3)D溶液为 ;同浓度的四种溶液中,pH值最大的是 (填化学式) 溶液。
(4)pH值和体积均相同的A和C溶液,分别与足量且大小完全相同的锌粒反应,开始时的反应速率v(A) v(C) (填“>”、“<”或“=”,下同),最终产生气体的物质的量n(A) n(C)。
(5)等体积等浓度的氨水和盐酸混合后,所得溶液呈 (填“酸性”、“碱性”或“中性”),用离子方程式解释其原因 。
(6)0.1mol/L氨水中除水分子以外的粒子有 (填化学式)。