某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2—、MnO4—、CO32—、SO42—、SiO32—中的若
干种组成(不考虑水的电离)。取该溶液进行如下实验:
Ⅰ.取适量溶液,加入过量的盐酸,有气体生成,并得到无色溶液;
Ⅱ.在Ⅰ所得溶液中加入过量的NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;
Ⅲ.在Ⅱ所得溶液中加入过量的Ba(OH)2溶液,加热,也有气体生成,同时析出白色沉淀乙。
请回答下列问题:
(1)由实验Ⅰ可知原溶液中一定不含有的离子是________;一定含有的离子是________________。
(2)由实验Ⅱ可知原溶液中还一定含有的离子是________;生成甲的离子方程式为________________。
(3)实验Ⅲ中生成白色沉淀乙的离子方程式为________________。
(4)原溶液中还可能存在的离子是________;检验该离子的方法是_________________。
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的元素。
(1)元素T的名称是
(2)J和氢元素组成的化合物A每个分子由4个原子组成,已知充分燃烧a gA物质时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则A物质燃烧热的热化学方程式是
(3)工业燃烧焦炭后的尾气中含有M和R组成的气体,为了测定其含量,可以选择的试剂是
| A.氢氧化钠溶液 | B.硫酸酸化的高锰酸钾溶液 | C.淀粉碘化钾溶液 | D.溴水溶液 |
(4)在微电子工业中,L的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为:
(5)由L和M组成的 两种价态相同的气体化合物可以相互转化,在同温同容的甲乙容器中分别加入1mol和2mol的LM2气体,分别建立平衡,则两容器中LM2的转化率比较甲乙(<,>,=)
两种价态相同的气体化合物可以相互转化,在同温同容的甲乙容器中分别加入1mol和2mol的LM2气体,分别建立平衡,则两容器中LM2的转化率比较甲乙(<,>,=)
(6)与J同主族的另一短周期元素和M组成的化合物有很广泛的用途,请说出其主要应用,写出两种
现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。(由实验装 置引起的实验误差忽略不计)。
置引起的实验误差忽略不计)。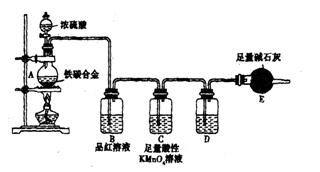
Ⅰ.探究 浓硫酸的某些性质
浓硫酸的某些性质
(1)称量E的质量;按照图示连续装置,检查装置的气密性。
(2)将mg铁碳合金样品放入A中,再加入适量的浓硫酸。未点燃酒精灯前,A、B均无明显现象,其原因是:。点燃酒精灯一段时间后,B中可观察到的明显现象是。
C中足量的酸性KMnO4溶液所起的作用是。D中盛放的试剂是。
(3)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是。
Ⅱ.测定铁的质量分数
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg,则铁碳合金中铁的质量分数为(写表达式)。某同学认为:依据此实验测得的数据,计算合金中铁的质量 分数可能会偏低,你认为可能的原因是。
分数可能会偏低,你认为可能的原因是。
(5)经过大家的讨论,决定采用右图装置和其他常用实验仪器测定某些数据即可,为了快速和准确地计算出铁的质量分数,最简便的实验操作是(填写代号)。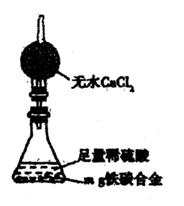
①用排水法测定H2的体积
②反应结束后,过滤、洗涤、干燥、称量残渣的质量
③测定反应前后装置和药品的总质量
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4)。
据此回答问题: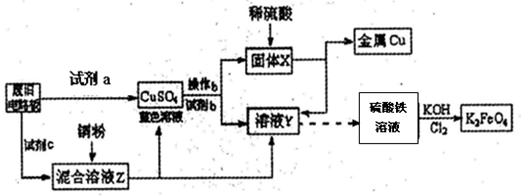
据此回答问题
(1)试剂a为试剂b为 (填写所选试剂代号)
| A.浓硫酸 | B.硫酸铁溶液 | C.氯水 | D.H2 O2和稀硫酸 E. Fe |
(2)加入过量试剂c,发生反应的离子方程式为__;溶液Z中金属离子可能有Cu2+、Fe2+、Fe3+,检验Fe3+的试剂为__ _ _(填化学式);欲测定溶液Z中Fe2+的浓度,需要用(填仪器名称)__ __配制一定浓度的KMnO4标准溶液。在滴定时KMnO4标准溶液应加入到(填“酸式”或“碱式”)滴定管中。
(3) K2FeO4是强氧化剂,与水发生反应:4FeO42-+10H2O="=" 4Fe(OH)3(胶体)+3O2↑+8OH-,产生11.2L(标况)O2时,转移电子的物质的量为。K2Fe04与FeCl3相比,净水效果更好的是_,理由是。
(4)高铁电池是一种新型可充电电池,总反应为:3Zn +2K2FeO4 +8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是:。
3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是:。
A、B、C、D、E是原子序数依次增大的短周期元素,A、D在周期表中的相对位置如表,且元素A的最高正化合价与最低负化合价的绝对值相差2,B与D属于同主族元素;元素C是一种银白色金属,放置在空气中会迅速变暗。
(1)D的原子结构示意图为;
(2)元素E在元素周期表中位于第族;
(3)C、D、E离子半径的大小关系为(用离子符号表示);
(4)元素B的单质与元素C的单质加热时生成化合物甲,化合物甲中所含化学键为
试写出甲与水反应的离子方程式;
(5)若乙是元素A的最简单气态氢化物,丙是元素C的最高价氧化物对应的水化物。
①pH相同的乙和丙的水溶液,分别用蒸馏水稀释到原来的x、y倍,稀释后两种溶液的pH仍然相同,则xy(填写“>”、“<”或“=” )
②在微电子工业中,乙的水溶液常用作刻蚀剂H2O2的清除剂,反应的产物不污染环境,其化学方程式为(不需要配平)。
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)
2SO2(g) +O2(g)
+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H0(填“>”或“<”);若在恒温、
2SO3(g)的△H0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡移动(填“向左”、“向右”或“不”);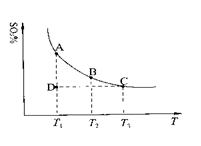
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1K2;若反应进行到状态D时,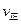
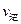 (填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,
请写出工业合成氨的热化学反应方程式:。
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水。在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4)c(Cl-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白 色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是,产生该现象的原因是(用离子方程式表示)。
色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是,产生该现象的原因是(用离子方程式表示)。
(已知25°C时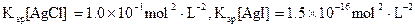 )
)