溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下: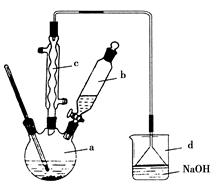
| |
苯 |
溴 |
溴苯 |
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/℃ |
80 |
59 |
156 |
| 水中溶解度 |
微溶 |
微溶 |
微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是____________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是________(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填入正确选项前的字母)。
A.25 mL B.50 mL C.250 mL D.500 mL
(共14分)某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如下装置:
(1)实验室常用装置E制各Cl2,写出该反应的离子方程式__________________________指出该反应中浓盐酸所表现出的性质
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D两个容器加热,两个容器中的现象分别为:BD
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是:。(用离子方程式进行说明)
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
某化学学习小组欲探究铁及其化合物的氧化性和还原性。请你协助他们完成实验报告。
(1)实验目的:探究铁及其化合物的氧化性和还原性
(2)实验试剂及仪器:
试剂:氯化亚铁溶液、氯化铁溶液、氯水、KSCN溶液、铁粉、锌片、铜片、稀硫酸
仪器:胶头滴管外,你认为本实验必不可少的一种玻璃仪器是。
(3)实验记录(在仿照①实验作答,划线部分不必填写)
| 序号 |
实验设计 |
实验观察(主要现象) |
离子方程式 |
解释与结论 |
| ① |
在铁粉中滴 入稀硫酸 |
铁粉溶解,溶液由无 色变成浅绿色,有无 色无味的的气体生成 |
Fe +2H+= H2↑+ Fe2+ |
Fe具有还原性 |
② |
氯化亚铁溶液中滴入KSCN溶液,再加入氯水 |
滴入KSCN溶液无明 显变化,加入氯水立 即变成血红色 |
||
| ③ |
氯化亚铁溶液加 入锌片 |
Fe2++ Zn =" Fe" + Zn 2+ |
||
④ |
Fe3+具有氧化性 |
(4)学习小组的同学将从本实验中获得的知识推广到其他类物质的学习,请判断下列物质既有氧化性又有还原性的是
A、Cl2B、Na C、Mg2+D、H2O2
(5)在实验②中,有部分同学在氯化亚铁溶液中滴入KSCN溶液后,就出现了血红色,你认为是什么原因:;
你将对实验员在配制氯化亚铁溶液时,提出的建议是。
(6)在配制氯化铁溶液时,由于实验员失误,可能导致溶液中含有少量的Fe2+,为帮助实验员进行检验少量Fe2+的存在,请从下列物质中选择合适的试剂()
A、KSCN溶液B、稀盐酸 C、KMnO4 溶液 D、NaOH溶液
某校探究学习小组同学用含有少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取“化学纯”级的NaCl,实验前他们设计了如下方案(框图)。
(1)请写出操作第④、⑤步所加试剂名称及第⑥步操作名称:④,⑤,⑥;
(2) 沉淀混合物C的化学成分有(用文字和化学式表示):;
(3)写出第⑤步操作中可能发生反应的离子方程式:
;
(4)如何用最简单方法检验第⑤步实验是否达到了目的:
;
(5)你认为该设计里哪些步骤调换后不影响实验结果:;
(6)有同学认为上述实验设计步骤可以简化,请你提出简化的一种设想:
。
用18 mol/L 的浓硫酸配制100 mL 3.0 mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解
④检漏、转移、洗涤⑤定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是,量取浓硫酸所用的量筒的规格是(用下列编号填空)。
| A.10ml | B.25ml | C.50ml | D.100ml |
(2)第③步实验的操是。
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线;改用向容量瓶中滴加蒸馏水至为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(4)转移溶液和直接加蒸馏水于容量瓶中要注意“两靠”:一靠是盛溶液的烧杯口靠在玻璃棒上部,二靠是玻璃棒下端靠在。
(5)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”、“偏小”、“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水;
②所用过的烧杯、玻璃棒未洗涤;
③加水超过刻度线后,用胶头滴管吸出多余的液体。
(10分)为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁(MgOHCl)的工艺。某同学根据该原理设计的实验装置如图: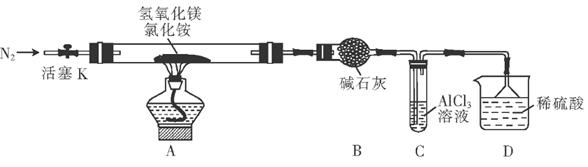
请回答下列问题:
(1) 装置A中发生反应生成碱式氯化镁的化学方程式为_____________;装置B中碱石灰的作用是_______。
(2) 反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,二是_____________________。
(3) 装置C的试管中产生的现象是______________,反应的离子方程式为