用酸性氢氧燃料电池电解饱和食盐水的装置如图所示(a、b为石墨电极,不考虑U形管
中气体的溶解且a上产生的气体全部进入小试管中)。下列说法中错误的是( )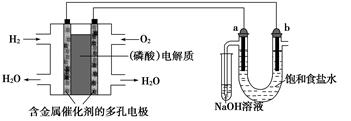
| A.同温同压下,燃料电池中参与反应的H2和O2的体积之比为2∶1 |
| B.同等条件下,U形管a、b两端产生的气体的密度之比为35.5∶1 |
| C.燃料电池中消耗0.2 g H2时,U形管中阴极产生的气体为2.24 L(标准状况下) |
| D.燃料电池中消耗1 mol O2时,小试管中反应转移的电子数约为4×6.02×1023 |
能正确表示下列反应的离子方程式是
| A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B.等物质的量的MgCl2、Ba(OH)2和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓ |
| C.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O ="HClO+" HSO3- |
| D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合: |
2Al3++3SO +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
下列各溶液中,一定能大量共存的是
| A.Fe3+、Na+、SO42-、H2O2 | B.C2H5OH、MnO4-、H+、K+ |
| C.Pb2+、K+、SO42-、Cl- | D.Na+、SO32- 、CH3COO-、S2- |
仅用下表提供的玻璃仪器(非玻璃仪器任选)不能实现相应实验目的的是
| 选项 |
实验目的 |
玻璃仪器 |
| A |
配制一定质量分数的NaCl溶液 |
胶头滴管、量筒、烧杯、玻璃棒 |
| B |
测定NaOH溶液浓度 |
滴定管、锥形瓶、烧杯 |
| C |
鉴别葡萄糖和蔗糖 |
试管、烧杯、酒精灯 |
| D |
实验室用浓氨水和生石灰制备氨气 |
普通漏斗、烧杯、玻璃棒 |
设NA代表阿伏加德罗常数,下列叙述正确的是
| A.标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023 |
| B.1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA |
| C.常温常压下42g乙烯和丁烯混合气体中,极性键数为6NA |
| D.6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
氮氧化铝(AlON)是一种透明高硬度防弹材料,可以由反应Al2O3+C+N2=2AlON+CO(高温)合成,下列有关说法正确的是
| A.氮氧化铝中氮的化合价是-3 |
| B.反应中氮气作氧化剂 |
| C.反应中每生成5.7g AlON 同时生成1.12 L CO |
| D.反应中氧化产物和还原产物的物质的量之比是2:1 |