已知A、B,C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按下图进行反应。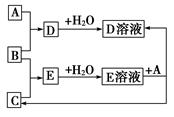
回答下列问题:
(1)A、B、C三种元素中的任意两种元素形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
(2)A、B、C三种元素中有一种是金属,则这种元素是A、B、C中的________,理由是________。
(3)如果E溶液是一种强酸,则E的化学式为________。
在下列物质中是同系物的有;互为同分异构体的有;互为同素异形体的有;互为同位素的有;
互为同一物质的有;
(1)液氯 (2)氯气 (3)白磷 (4)红磷 (5)D (6)T
(7) 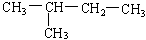
(8) 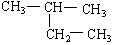
(9)CH2 = CH-CH3
(10) 
(11)2,2—二甲基丁烷
按要求完成下列问题
(1)在反应SO2 + Cl2 + 2H2O =" 2HCl" + H2SO4中,氧化剂是:________________,
还原剂是:____________,还原产物是:__________,氧化产物是:__________。(填化学式)
(2)过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A-D涉及H2O2的反应,填写空白:
| A.Na2O2 +2HCl= 2NaCl+H2O2 |
| B.Ag2O+ H2O2=2Ag+O2+ H2O |
| C.2 H2O2="2" H2O+O2↑ |
| D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O |
①H2O2仅体现氧化性的反应是(填代号)
②H2O2既体现氧化性又体现还原性的反应是(填代号)。
按要求完成下列内容。
(1)写出下列物质的电离方程式
盐酸
氢氧化钠溶液
氯化钡溶液
碳酸氢钠溶液
(2)写出下列反应的离子方程式
①锌和稀硫酸溶液的反应:
②碳酸钙与稀盐酸的反应:
③氯化铜溶液与氢氧化钠溶液的反应:
(3)写出符合离子方程式Ag++Cl-=AgCl↓的一种化学方程式。
工业制氢气的一个重要反应是:CO(g)+H2O(g)  CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡状态所需时间/min |
||
| CO |
H2O |
H2 |
CO2 |
|||
| I |
650 |
4 |
2 |
1.6 |
1.6 |
5 |
| II |
900 |
2 |
1 |
0.5 |
0.5 |
3 |
①对于反应CO(g)+H2O(g)  CO2(g)+H2(g),下列说法正确的是
CO2(g)+H2(g),下列说法正确的是
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率 (CO)=;
(CO)=;
③实验II条件下反应的平衡常数K=(保留小数点后二位);H2O(g)的平衡转化率为。
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1.5molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则平衡向方向移动(填“正反应”、“逆反应”或“不移动”)
⑤若仅改变温度,纵坐标y随T变化如图所示,则纵坐标y表示的是。
A.CO2的百分含量 B.混合气体的平均相对分子质量
C.CO的转化率D.H2O的物质的量
熔融盐燃料电池具有较高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO-3)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26 CO32--52e-===34CO2+10H2O。
试回答下列问题:
(1)该燃料电池中发生氧化反应的物质是。
(2)该燃料电池的化学反应方程式为;
(3)某学生想用该燃料电池电解饱和食盐水,写出反应的离子方程式。
(4)当电路中通过0.26NA的电子时,消耗的氧气的体积(标况)为;此时电解饱和食盐水生成的氯气的物质的量是;若此时溶液体积为200ml,则生成的NaOH的物质的量浓度为。