某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32—、SO42—
中的若干种离子组成,取该溶液进行如下实验: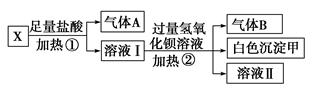
(1)白色沉淀甲是________。
(2)试写出实验过程中生成气体A、B的离子方程式
__________________________、_______________________________
(3)通过上述实验,可确定X溶液中一定存在的离子是
________,尚未确定是否存在的离子是________。
已知3.01×1023个X气体分子的质量为16g,则X气体的摩尔质量是
洗涤沉淀的方法:;在NaCl 溶液中滴加AgNO3溶液,反应后证明AgNO3不足的方法:
;
将下列各分离物质方法的代表字母,填在各小题末的横线上:
| A.过滤法; | B.结晶法; | C.分液法; | D.萃取分液法;E.蒸馏法; |
(1)除去食盐水中的泥沙_____________
(2)除去植物油中的水_______________
(3)将溶液中的硝酸钾与氯化钠分离____________
(4)将自来水制为纯净水______________
在标准状况下,44.8L的NH3气体质量为g, 其中含个氢原子,其中含molN;将其溶于水配成200mL的溶液,其物质的量浓度为 _mol/L。
等物质的量的CH4和NH3两种气体中, H原子数之比为,二者的质量之比为,在同温同压下的体积之比为。
. (14分)已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ |
700 |
900 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=,△H0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)=mol·L-1, C的物质的量为mol;若反应经一段时间后,达到平衡时A的转化率为,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为;
(3)判断该反应是否达到平衡的依据为(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为。
A(g)+B(g)的平衡常数的值为。