工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠
(Na2Cr2O7·2H2O),其主要反应:( )
①4FeO·Cr2O3+8Na2CO3+7O2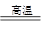 8Na2CrO4+2Fe2O3+8CO2 ②2Na2CrO4+H2SO4
8Na2CrO4+2Fe2O3+8CO2 ②2Na2CrO4+H2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法不正确的是( )
| A.反应①和②均为氧化还原反应 |
| B.Na2Cr2O7在碱性条件下可转化为Na2CrO4 |
| C.高温下,O2的氧化性大于Fe2O3和Na2CrO4的 |
| D.生成1 mol Na2Cr2O7时转移电子的物质的量大于7 mol |
由2-氯丙烷制取少量的1,2-丙二醇时,需要经过的各反应分别为
| A.加成反应,消去反应,取代反应 | B.消去反应,加成反应,取代反应 |
| C.取代反应,消去反应,加成反应 | D.取代反应,加成反应,消去反应 |
下列物质既能发生消去反应,又能发生水解反应的是
| A.一氯甲烷 | B.2-甲基-1-溴丙烷 |
| C.2,2-二甲基-1-氯丙烷 | D.2,2,4,4-四甲基-3-氯戊烷 |
下列有关化学用语表示正确的是
| A.乙醇的结构简式C2H6O |
B.氨基的电子式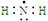 |
C.镁离子的结构示意图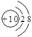 |
D.中子数为79、质子数为55 的铯(Cs)原子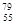 Cs Cs |
2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行。能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是
| A.点燃,能燃烧的是矿物油 |
| B.测定沸点,有固定沸点的是矿物油 |
| C.加入水中,浮在水面上的是地沟油 |
| D.加入足量氢氧化钠溶液共热,不分层的是地沟油 |
维生素C的结构简式为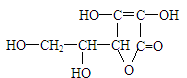 ,有关它的叙述,正确的是
,有关它的叙述,正确的是
| A.分子中含有苯环 | B.能发生氧化反应和加成反应 |
| C.难溶于水 | D.在碱性溶液中能稳定地存在 |