根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是( )
| 元素代号 |
A |
B |
C |
D |
E |
| 原子半径/nm |
0.186 |
0.143 |
0.089 |
0.102 |
0.074 |
| 主要化合价 |
+1 |
+3 |
+2 |
+6、-2 |
-2 |
A.最高价氧化物对应水化物的碱性A>C
B.氢化物的沸点H2D>H2E
C.单质与稀盐酸反应的速率A<B
D.C2+与A+的核外电子数相等
将足量的铜屑加入到100 mL浓度均为2 mol·L-1的HNO3和H2SO4的混合溶液中,充分反应后,转移电子的物质的量为 ( )
| A.0.6 mol | B.0.8 mol | C.0.45 mol | D.0.4 mol |
反应(1)、(2)分别是从海藻灰和智利硝石中提取碘的主要反应:
2NaI+MnO2+3H2SO4===2NaHSO4+MnSO4+2H2O+I2(1)
2NaIO3+5NaHSO3===2Na2SO4+3NaHSO4+H2O+I2(2)下列说法正确的是 ( )
| A.两个反应中NaHSO4均为氧化产物 |
| B.I2在反应(1)中是还原产物,在反应(2)中是氧化产物 |
C.氧化性:MnO2>SO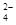 >IO >IO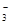 >I2 >I2 |
| D.反应(1)、(2)中生成等量的I2时转移电子数比为1∶5 |
金属铜的提炼多从黄铜矿开始,黄铜矿在焙烧过程中主要反应之一的化学方程式为
2CuFeS2+O2===Cu2S+2FeS+SO2下列说法不正确的是 ( )
| A.O2只作氧化剂 |
| B.CuFeS2既是氧化剂又是还原剂 |
| C.SO2既是氧化产物又是还原产物 |
| D.若有1 mol O2参加反应,则反应中共有4 mol电子转移 |
锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为( )
| A.2 mol | B.1 mol | C.0.5 mol | D.0.25 mol |
下列叙述中,正确的是()
| A.含最高价元素的化合物,一定具有强氧化性 |
| B.阳离子只有氧化性,阴离子只有还原性 |
| C.失电子越多,还原能力越强 |
| D.强氧化剂与强还原剂不一定能发生氧化还原反应 |