下列说法正确的是( )
| A.自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 |
| B.Si、P、S、Cl相应的最高价氧化物对应水化物的酸性依次增强 |
| C.工业上通常用电解钠、铁、铜对应的氯化物制得该三种金属单质 |
| D.金属铝、铁、铜都有一定的抗腐蚀性能,其抗腐蚀的原因都是表面形成氧化物薄膜,阻止反应的进一步进行 |

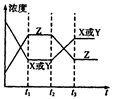
| A.该反应的化学反应速率可用单位时间内X或Y反应物浓度的减少值来表示 |
| B.该反应的化学反应速率可用Z浓度的增加值来表示 |
| C.相同条件下,若vx=0.1mol/(L·S),vz=0.2mol/(L·S),则vx表示的反应速率比vz大 |
| D.该反应的化学反应速率是指单位时间内X或Z浓度的变化值 |

(1)反应达到平衡时,放出的热量 。
A.小于92.2 kJ B.等于92.2 kJ C.大于92.2 kJ
(2)保持同一温度,在相同的容器中,若起始时加入2 mol NH3、1mol H2及固体催化剂,反应达到平衡时NH3的体积分数 。
A.等于0.25 B.大于0.25 C.小于0.25
(3)保持同一温度,在相同的容器中,起始通入一定物质的量N2、H2、NH3,欲使平衡时NH3的体积分数一定等于0.25。且起始时向正反应方向进行,
则充入N2的物质的量a(mol)的取值范围是 。
(4)右图是Tl℃时容器中NH3的物质的量随时间的变化曲线,
请在该图中补画出该反应在T2℃(T2>T1)时n(NH3)的变化
曲线。
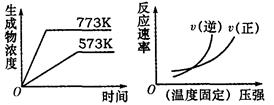
A.N2(g) +3H2(g) 2NH3(g)△H=—Q1kJ·mol—1(Q1>0) 2NH3(g)△H=—Q1kJ·mol—1(Q1>0) |
B.2SO3(g) 2SO2(g)+O2(g)△H=+Q2kJ·mol—1(Q2>0) 2SO2(g)+O2(g)△H=+Q2kJ·mol—1(Q2>0) |
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H=-Q3kJ·mol—1(Q3>0) 4NO(g)+6H2O(g)△H=-Q3kJ·mol—1(Q3>0) |
D.H2(g) +CO(g) C(s)+H2O(g)△H=+Q4kJ·mol—1(Q4>0) C(s)+H2O(g)△H=+Q4kJ·mol—1(Q4>0) |
| A.增大了X或Y的浓度 |
| B.使用了催化剂 |
| C.增大了体系压强 |
| D.升高了该反应的温度 |