一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )
xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )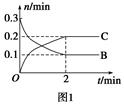
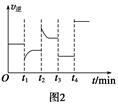
A.x=2,反应开始2 min内v(B)=0.1 mol·L-1·min-1
B.t1时是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
根据碘与氢气反应的热化学方程式
①I2(g)+H2(g) 2HI(g) ΔH 1=" -9.48" kJ/mol
2HI(g) ΔH 1=" -9.48" kJ/mol
②I2(s)+H2(g) 2HI(g) ΔH 2=" +26.48" kJ/mol,
2HI(g) ΔH 2=" +26.48" kJ/mol,
下列判断正确的是
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应①的产物比反应②的产物稳定 |
| D.反应②的反应物总能量比反应①的反应物总能量低 |
一定温度下,下列溶液的离子浓度关系式正确的是
| A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol/L |
| B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-) |
| D.pH相同的①CH3COONa、②NaHCO3两种溶液的c(Na+):①>② |
有关下列图象的说法正确的是
| A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0 |
| B.图乙表示向pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,则其中曲线a对应的是醋酸 |
| C.图丙表示该反应为放热反应.且催化剂能降低反应的活化能、改变反应物的焓 |
| D.图丁中开关K置于a或b处均可减缓铁的腐蚀 |
下图是关于反应A2(g)+3B2(g) 2C(g) ΔH<0,的平衡移动图像,影响平衡移动的原因是
2C(g) ΔH<0,的平衡移动图像,影响平衡移动的原因是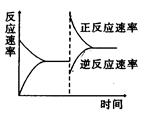
| A.升高温度,同时加压 |
| B.降低温度,同时减压 |
| C.增大反应物浓度,同时使用催化剂 |
| D.增大反应物浓度,同时减小生成物浓度 |
在恒容密闭容器中,可以作为2NO2(g) 2NO(g)+O2(g)达到平衡状态的标志是:①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定
2NO(g)+O2(g)达到平衡状态的标志是:①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定
| A.①③⑤⑦ | B.②④⑤ | C.①③④ | D.①②③④⑤ |