在恒容密闭器中通入物质的量浓度均0.1 mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图,下列有关说法一定正确的是( )
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图,下列有关说法一定正确的是( )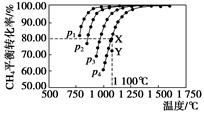
| A.上述反应的ΔH>0 |
| B.压强p1>p2>p3>p4 |
| C.1 100 ℃该反应的平衡常数为64 |
| D.压强为p4时,在Y点:v(正)<v(逆) |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍也是Y原子最外层电子数的3倍。下列说法正确的是( )
| A.Y与Z形成的简单离子核外电子排布相同 |
| B.X的氧化物为离子化合物 |
| C.Z的氢化物的水溶液在空气中容易变质 |
| D.X与Z对应的氧化物的水化物一定为强酸 |
如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )
| A.N、Z两种元素的离子半径相比前者较大 |
| B.M、N两种元素的气态氢化物的稳定性相比后者较强 |
| C.X与M两种元素组成的化合物能与碱反应,但不能与任何酸反应 |
| D.工业上常用电解Y和N形成的化合物的熔融态制取Y的单质 |
X、Y、Z三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为常见的10电子分子。下列说法不正确的是( )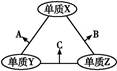
| A.X元素位于ⅥA族 |
| B.A不能溶解于B中 |
| C.A和C不可能发生氧化还原反应 |
| D.B的沸点高于C的沸点 |
下列说法错误的是( )
| A.原子最外层电子数为2的元素一定处于周期表ⅡA族 |
| B.主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 |
| C.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
依据元素周期表及元素周期律,下列推断正确的是( )
| A.同周期主族元素的原子形成的简单离子电子层结构相同 |
| B.C比Si的原子半径小,CH4的稳定性比SiH4弱 |
| C.Na、Mg、Al失电子能力和其最高价氧化物对应的水化物的碱性均依次减弱 |
| D.在元素周期表金属与非金属的分界处可以寻找催化剂和耐高温、耐腐蚀的合金材料 |