为测定某未知浓度的氢氧化钡溶液的溶质质量分数,取某稀硫酸溶液20 g,逐滴加入氢氧化钡溶液30 g,同时用pH计测定并记录反应过程中混合溶液pH的变化情况(如图所示)。过滤后得滤液47.67 g。请你通过计算 ,求出氢氧化钡溶液的溶质质量分数。
向13.6g碳酸钠和氯化钠的固体混合物滴加稀盐酸,所加稀盐酸质量与生成气体质量的关系
如图所示。计算: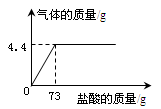
(1)固体混合物中碳酸钠的质量。
(2)该稀盐酸中溶质的质量分数。
(3)恰好完全反应时所得的溶液中溶质的质量分数。
(计算结果精确至0.1%)
某校课外兴趣小组对一批粗锌样品(含有杂质,杂质不溶于水,也不与酸反应)进行分析,甲、乙、丙三组同学分别进行实验,实验数据记录如下:
| 组别 药品 |
甲 |
乙 |
丙 |
| 烧杯 + 稀硫酸/g |
152.5 |
152.5 |
252.5 |
| 粗锌样品/g |
20 |
15 |
15 |
| 烧杯及剩余物/g |
172.1 |
167.1 |
267.1 |
请你认真分析数据,帮助他们回答下列问题(每组反应均充分):
(1)组同学所取用的稀硫酸与粗锌样品恰好完全反应;
(2)计算粗锌样品中锌的质量分数;
(3)计算原硫酸溶液中溶质的质量分数;
(4)计算恰好完全反应的那组实验所得溶液中溶质的质量分数(烧杯质量为52.5g,计算结果精确到0.1%)
双氧水(H2O2)既是工业上重要的绿色氧化剂,又是常用的医用消毒剂。
(1)小明配制了5%的双氧水600g,则600 g溶液中溶质为克,溶剂为克。
(2)小明倒出了300 g双氧水溶液进行消毒,则剩下的溶液中溶质的质量分数为。
将250g含杂质(杂质不参加反应,也不溶于水)60%的大理石放到500g稀盐酸中,恰好完全反应。求:
(1)生成二氧化碳多少克?(2)所用稀盐酸的溶质的质量分数是多少?
(3)所得溶液的溶质质量分数是多少?(计算结果精确到0.1%)
某校化学兴趣小组为测定空气中二氧化硫的含量,用NaOH溶液吸收SO2。用NaOH溶液吸收100L已除去CO2的空气样品,溶液质量增加了0.64g.已知此时空气的密度为1.3g/L,求:
(1)被吸收的SO2的质量.
(2)发生反应的NaOH的质量.
(3)空气中SO2的质量分数(计算结果精确到0.01%).