白磷与氧气可发生如下反应:P4+5O2 P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P
P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P O c kJ·mol-1、O
O c kJ·mol-1、O O d kJ·mol-1。
O d kJ·mol-1。
根据下图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )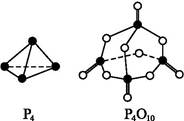
| A.(6a+5d-4c-12b) kJ·mol-1 |
| B.(4c+12b-6a-5d) kJ·mol-1 |
| C.(4c+12b-4a-5d) kJ·mol-1 |
| D.(4a+5d-4c-12b) kJ·mol-1 |
工业上进行下列物质的制取,其所示的物质转化关系中,正确的是
| A.以食盐为原料制取HCl:2NaCl+2H2O2NaOH+H2↑+Cl2↑、H2+Cl22HCl |
| B.以铜和硫酸为原料制取硫酸铜:2Cu+O22CuO、CuO+H2SO4===CuSO4+H2O |
| C.从海水中提取MgCl2:MgCl2+2NaOH===Mg(OH)2↓+2NaCl、Mg(OH)2+2HCl===MgCl2+2H2O |
| D.以磁铁矿石(Fe3O4)和焦炭为原料冶炼铁:Fe3O4+2C3Fe+2CO2↑ |
(NH4)2SO4在高温下分解,产物是SO2、H2O、N2和NH3。在该反应的化学方程式中,化学计量数由小到大的产物分子依次是
| A.SO2、H2O、N2、NH3 |
| B.N2、SO2、H2O、NH3 |
| C.N2、SO2、NH3、H2O |
| D.H2O、NH3、SO2、N2 |
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2―→H2O IO―→I2 MnO―→Mn2+ HNO2―→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
| A.H2O2 | B.IO | C.MnO | D.HNO2 |
将空气缓慢通过图中a~d装置时,依次除去的气体分别是
| A.O2、N2、H2O、CO2 |
| B.CO2、H2O、O2、N2 |
| C.H2O、CO2、N2、O2 |
| D.N2、O2、CO2、H2O |
北京时间2008年10月15日消息,据美国太空网报道,目前,研究人员正利用欧洲航天局的“金星快车”卫星——绕我们的邻居金星轨道运行——在远距离对地球进行研究,旨在寻找适于生命居住迹象。三氧化二碳(C2O3)是金星大气层的成分之一。下列有关C2O3的说法正确的是
| A.C2O3和CO2是同素异形体 |
| B.C2O3和CO燃烧产物都是CO2 |
| C.C2O3和CO都是酸性氧化物 |
| D.C2O3和CO2都是碳酸的酸酐 |