已知强酸与强碱的稀溶液发生中和反应的热化学方程式为:H+(aq)+OH-(aq) H2O(l) ΔH="-57.3" kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。其焓变ΔH1、ΔH2、ΔH3的关系是( )
H2O(l) ΔH="-57.3" kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。其焓变ΔH1、ΔH2、ΔH3的关系是( )
| A.ΔH1>ΔH2>ΔH3 | B.ΔH1<ΔH3<ΔH2 |
| C.ΔH1=ΔH3>ΔH2 | D.ΔH1>ΔH3>ΔH2 |
将4.34gNa、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672mL混合气体,该混合气体通过放电,恰好完全反应,则它们的物质的量之比为
| A.1:1:1 | B.1:1:2 | C.1:2:1 | D.4:3:2 |
通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是
| A.HCl | B. |
C. |
D.NO |
用Pt电极电解KCl和CuSO4的混合溶液,当电路中通过0.4mol电子的电量时,阴阳两极都产生0.14mol的气体,若电解后溶液体积为40L,则电解后溶液的pH为()
| A.1 | B.3 | C.7 | D.11 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn +2K2FeO4 +8H2O 3Zn(OH)2 +2Fe(OH)3 + 4KOH, 不正确的是( )
3Zn(OH)2 +2Fe(OH)3 + 4KOH, 不正确的是( )
| A.放电时负极反应为:Zn – 2e- + 2OH- = Zn(OH)2 |
| B.充电时阳极反应为:Fe(OH)3 - 3e- + 5OH- = FeO42- + 4H2O |
| C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
如右图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02mol电子通过,正确的是()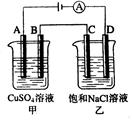
A.甲烧杯中A极上最多可析出铜0.64g
B.甲烧杯中B极上电极反应式4OH--4e-=2H2O+O2↑
C.乙烧杯中滴入酚酞试液,D极附近先变红
D.烧杯中C极上电极反应式为4H++4e-=2H2↑