在36 g碳不完全燃烧所得气体中,CO占体积,CO2占体积。且有:
C(s)+O2(g) CO(g) ΔH="-110.5" kJ·mol-1
CO(g) ΔH="-110.5" kJ·mol-1
CO(g)+O2(g) CO2(g) ΔH="-283" kJ·mol-1
CO2(g) ΔH="-283" kJ·mol-1
与这些碳完全燃烧相比,损失的热量是( )
| A.172.5 kJ | B.1 149 kJ | C.283 kJ | D.517.5 kJ |
下列说法正确的组合是 ( )
①用溴水除去混在苯中的己烯,分液得到纯净的苯
②将电石与水反应产生的乙炔通入溴水中,溴水褪色,证明乙炔和溴水发生了加成反应
③将溴乙烷和NaOH乙醇溶液混合共热,生成的气体直接通入酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色,说明有乙烯生成
④用淀粉碘化钾试纸和白醋溶液可以检验加碘盐中的碘元素
⑤油脂在NaOH稀溶液中发生水解反应后,若静置不分层,说明水解完全
⑥丙氨酸中有手性碳原子
| A.①②③ | B.④⑤⑥ | C.②③④ | D.③④⑤ |
下列反应的离子方程式正确的是 ( )
A.乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH-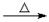 CH3COO- +CH3CH2O- +H2O CH3COO- +CH3CH2O- +H2O |
B.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-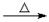 CH2BrCOO-+H2O CH2BrCOO-+H2O |
C.苯酚钠溶液中通入少量二氧化碳:CO2 + H2O + 2C6H5O-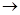 2C6H5OH + 2CO32- 2C6H5OH + 2CO32- |
D.乙醛溶液与新制氢氧化铜碱性悬浊液共热CH3CHO+2Cu(OH)2+OH--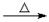 CH3COO-+ Cu2O↓+ 3H2 CH3COO-+ Cu2O↓+ 3H2 |
下列关系正确的是
| A.沸点:苯酚>甲醛>2一甲基丁烷 |
| B.2,2,3,3-四甲基丁烷、新戊烷、乙烷中化学环境相同的H原子种类由多到少 |
| C.密度:溴苯 >H2O >苯 |
| D.等物质的量物质燃烧耗O2量:己烷>苯>C6H5COOH |
NA为阿伏加德罗常数,下列说法正确的是
| A.1Llmol/L的Na2CO3溶液中含有的CO32-数目为NA |
| B.1 mol羟基(-OH)所含的电子数约为l0NA |
| C.1 mol丙烯分子有2 mol σ 键,1 mol π 键 |
| D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是 ( )
Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液④H2O ⑤Na ⑥Br2/H2O ⑦Br2/CCl4
Ⅱ.装置: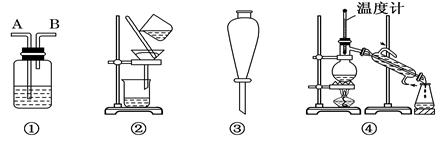
| 选项 |
物质 |
试剂 |
装置 |
| A |
C2H6(C2H4) |
⑥ |
① |
| B |
苯(苯酚) |
① |
③ |
| C |
CH3COOC2H5(CH3COOH) |
③ |
② |
| D |
甲苯(二甲苯) |
① |
③ |