在容积为2 L的密闭容器中充入2 mol SO2和一定量O2,发生反应2SO2+O2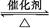 2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min末时,容器中SO2的物质的量是( )
2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min末时,容器中SO2的物质的量是( )
| A.等于1.6 mol | B.等于1.2 mol | C.大于1.6 mol | D.小于1.2 mol |
一定能在下列溶液中大量共存的离子组是()
| A.含有大量ClO-的溶液:Na+、Ca2+、SO32-、I- |
| B.含有大量NH4+的溶液:K+、Al3+、Ag+、NO3- |
| C.含有大量Fe3+的溶液:K+、Ba2+、NO3-、SCN- |
| D.水电离出来的c(H+)=1×10-3mol·L-1的溶液:Na+、K+、CO32-、SO42- |
有一种白色粉末由等质量的两种物质混合而成,分别取适量该白色粉末置于3支
试管中进行实验。
①逐滴加入6.0mol•L-1盐酸,同时不断振荡试管,有气泡产生,反应结束后得到无色透明溶液。
②加热试管中的白色粉末,试管口有水滴凝结。
③逐滴加入6.0mol•L-1硫酸,同时不断振荡试管,有气泡产生,反应结束后试管中还有白色不溶物。
下列混合物中符合以上实验现象的是()
| A.NaHCO3、AgNO3 | B.BaCl2、MgCO3 |
| C.NH4HCO3、MgCl2 | D.BaCl2、NaHCO3 |
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A.20 g重水(D2O)中含有的电子数为10NA |
| B.100 mL 2.0 mol•L-1的盐酸与醋酸溶液中氢离子均为0.2NA |
| C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA |
| D.5.6 g铁与足量盐酸反应转移的电子数为0.3NA |
X、Y、Z三种元素的原子序数相连,元素X易获得电子成为稳定的离子,元素Z
易失去电子成为稳定的离子。下列说法中,不正确的是()
| A.Y原子中电子数较X原子多一个,但比Z原子少一个 |
| B.Y单质和Z、X的单质均可以反应 |
| C.元素Z为活泼的金属,其单质跟水反应放出氢气,生成物的水溶液显碱性 |
| D.X原子与氢反应能形成HX |
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)====CO2(g)△H= -393.51kJ•mol-1
C(金刚石)+O2(g)====CO2(g)△H= -395.41kJ•mol-1
据此判断,下列说法正确的是()
| A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石低 |
| B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石高 |
| C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石低 |
| D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石高 |