氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快。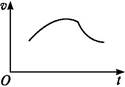
(1)反应开始时反应速率加快的原因是
(2)反应后期反应速率减慢的原因是 。
下列物质(均为中学化学常见物质)转化关系如图所示,已知D为红棕色粉末(反应条件及部分反应物、产物未全部标出).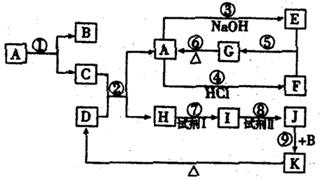
根据图示转化关系填写下列空白:
(1)写出下列物质的化学式:
A:;B:;E:;K:;
(2)C与D的混合物通常叫做(填名称).
(3)写出下列化学反应方程式(注明反应条件,若是离子反应的写离子方程式):
①;
②;
③;
(1)在Fe(OH)3胶体中逐滴加入HI稀溶液,会出现一系列变化:
①先出现红褐色沉淀,原因是:;
②随后沉淀溶解,溶液呈黄色,写出此过程反应的离子方程式:;
③最后溶液颜色加深,原因是:,此过程的离子方程式是:;④如用稀盐酸代替HI稀溶液,能出现上述哪些相同的实验现象:(写序号)。
(2)2.00gC2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,写出该反应燃烧的热化学反应方程式;
已知反应①、②是化工生产中的两个重要反应
①甲溶液 A + B + C
A + B + C
②乙经过粉碎后在沸腾炉中燃烧,得到D和E
其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体。请回答:
(1)A的电子式是。
(2)将A通入B的溶液中,反应的离子方程式是。
(3)1 g C在A中燃烧时放出92.3 kJ的热量,该反应的热化学方程式是。
(4)工业上可利用E为原料冶炼其中所含的金属,方法是。
(5)化工生产②中第二步、第三步用到的设备名称分别为、。第二步采用的反应条件为。
(6)将A和D按物质的量1:1通入下列装置中: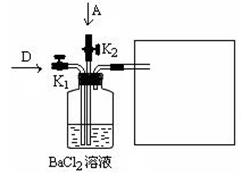
该过程中的化学方程式是:_______________________。
上述实验装置设计不完整,请将所缺部分在装置图的右边方框中画出。
(7)一定条件下,将12 g乙放入过量的的浓硝酸中,反应过程中转移1.5 mol电子,该反应的离子方程式是。
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题。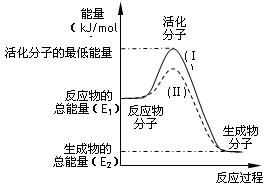
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的△H=___________________kJ/mol(用含E1、E2的代数式表示)
(2)已知热化学方程式:H2(g)+ 0.5 O2(g)=H2O(g);△H=-241.8 kJ/mol
该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是:___________________________。
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示: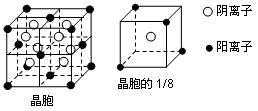
(1)A和E所形成的化合物的电子式是
(2)A、B、C、D四种元素的原子半径由小到大的顺序为(用元素符号表示)
(3)A和D的氢化物中,后者沸点较低,原因是____________
(4)A和E的化合物晶体中,每个阳离子的周围与它最近且等距离的阳离子共有个
(5)已知A和E所形成的化合物晶体的晶胞体积为1.6×10-22cm3,则A和E组成的离子化合物的密度为(结果保留一位小数)。