在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g) ΔH="Q" kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) ΔH="Q" kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
| 气体体积/L c(Y)/(mol·L-1) 温度/℃ |
1 |
2 |
3 |
| 100 |
1.00 |
0.75 |
0.53 |
| 200 |
1.20 |
0.90 |
0.63 |
| 300 |
1.30 |
1.00 |
0.70 |
下列说法正确的是( )
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减小
D.体积不变,温度升高,平衡向逆反应方向移动
下列叙述正确的是
A.电化学反应不一定是氧化还原反应 |
B.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
C.2NO+2CO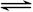 2CO2+N2的△H<0,则该反应一定能自发进行 2CO2+N2的△H<0,则该反应一定能自发进行 |
D.用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
已知:在100℃时,纯水的c(H+)为1×10—6,此时将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=10,则V1∶V2为
| A.1∶9 | B.10∶1 | C.9∶1 | D.1∶10 |
有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2 、V3,则三者的大小关系正确的是
、V3,则三者的大小关系正确的是
| A.V3>V2>V1 | B.V3=V2=V1 | C.V1=V2>V3 | D.V3>V2=V 1 1 |
下列事实不能用勒夏特列原理解释的是
A.氯水中有平衡:Cl2+H2O HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅。 HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅。 |
B.对CO(g)+NO2(g) CO2(g)+NO(g),平衡体系增大压强可使颜色变深。 CO2(g)+NO(g),平衡体系增大压强可使颜色变深。 |
| C.升高温度能够促进水的电离 |
| D.SO2催化氧化成SO3的反应,往往加入过量的空气 |
下列说法正确的是
| A.pH=5的盐酸,再加水冲稀1000倍,溶液的pH=8 |
| B.给稀醋酸溶液加热,溶液pH值增大 |
| C.pH=1的盐酸中c(H+)是pH=3的盐酸的c(H+)100倍 |
| D.在H2CO3溶液中,C(H+) :C(CO32—-)=2∶1 |