常温下,在0.01 mol·L-1硫酸溶液中,水电离出的氢离子浓度是( )
| A.5×10-13 mol·L-1 | B.0.02 mol·L-1 |
| C.1×10-7 mol·L-1 | D.1×10-12 mol·L-1 |
某有机物A的化学式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有()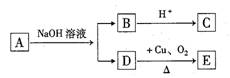
A.2种 B.3种 C.4种 D.5种
下列操作中错误的是( )
| A.除去乙酸乙酯中的少量乙酸:加入含乙醇的浓硫酸,使乙酸全部转化为乙酸乙酯 |
| B.除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层 |
| C.除去CO2中的少量SO2:通过盛有饱和NaHCO3溶液的洗气瓶 |
| D.提取溶解在水中的少量碘:加入CCl4,振荡、静置分层后,取出有机层再分离 |
最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是()
A. 分子中三个碳原子可能处于同一直线上
B. 全氟丙烷的电子式为: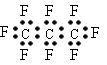
C. 相同压强下,沸点:C3F8<C3H8
D. 全氟丙烷分子中既有极性键又有非极性键
设NA表示阿佛加德罗常数的值,下列叙述中一定正确的是()
| A.1molFeCl3制成胶体,所得胶体的粒子数为NA |
B.常温常压下乙烯和丁烯混合气a克,其中C—H键的数目为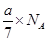 |
| C.0.5mol/L 1升Al(NO3)3溶液中,Al3+的数目为0.5NA |
| D.标准状况下,22.4升庚烷中含碳原子数为7NA |
化学在人类生活中扮演着重要角色,以下应用正确的是()
| A.用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 |
| B.为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 |
| C.使用无磷洗衣粉,可彻底解决水体富营养化问题 |
| D.天然药物无任何毒副作用,可长期服用 |