向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列说法正确的是( )
| A.开始时产生的气体为H2 |
| B.AB段产生的反应为置换反应 |
| C.所用混合溶液中c(HNO3)=0.5 mol·L-1 |
| D.参加反应铁粉的总质量m2=5.6 g |
对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是( )
2SO3(g),能增大正反应速率的措施是( )
| A.通入大量O2 | B.增大容器容积 | C.移去部分SO3 | D.降低体系温度 |
已知热化学方程式:①CO(g) + 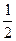 O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
②H2(g) +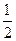 O2(g)=H2O(g);ΔH="-241.8" kJ·mol-1则下列说法正确的是()
O2(g)=H2O(g);ΔH="-241.8" kJ·mol-1则下列说法正确的是()
| A.H2的燃烧热为241.8kJ·mol-1 |
B.由反应①、②可知右图所示的热化学方程式为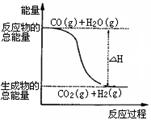 CO(g)+H2O(g)=CO2(g)+H2(g) CO(g)+H2O(g)=CO2(g)+H2(g)ΔH="-41.2" kJ·mol-1 |
| C.H2(g)转变成H2O(g)的化学反应一定要释放能量 |
D.根据②推知反应H2(g) +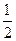 O2(g)=H2O(l); O2(g)=H2O(l); |
ΔH>-241.8 kJ·mol-1
已知H2(g)+Cl2(g)="2HCl(g)" △H= ―184.6kJ·mol-1,则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为 ( )
| A.+184.6kJ·mol-1 | B.―92.3kJ·mol-1 | C.+92.3kJ | D.+92.3kJ·mol-1 |
由:①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol可知:()
| A.①的反应热为221 kJ/mol |
| B.稀硫酸与Ba(OH)2稀溶液反应的中和热为57.3 kJ/mol |
| C.碳的燃烧热大于110.5 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量 |
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l)△H=Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g)△H=Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是()
| A.Q1>Q2>Q3 | B.Q1>Q3>Q2 | C.Q3>Q2>Q1 | D.Q2>Q1>Q3 |