有4.8 g CuO、Fe2O3混合物跟足量CO充分反应后固体减少1.28 g,反应后全部气体用0.6 mol·L-1 Ba(OH)2溶液100 mL吸收。下列有关叙述中正确的是( )
| A.原混合物中CuO与Fe2O3物质的量的比为1∶2 |
| B.原混合物中CuO与Fe2O3的质量比为2∶1 |
| C.吸收CO2后溶液中一定有Ba(HCO3)2 |
| D.反应中生成的CO2体积为1.792 L |
下列说法正确的是
| A.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 |
| B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,说明BaCl2溶液显酸性 |
| C.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 |
D.汽车尾气的净化反应2NO+2CO 2CO2+N2△H<0,则该反应一定能自发进行 2CO2+N2△H<0,则该反应一定能自发进行 |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是
| A.原子半径的大小顺序:rX>rY> rW >rQ |
| B.X、Y的最高价氧化物的水化物之间不能发生反应 |
| C.元素Q和Z能形成QZ2型的共价化合物 |
| D.Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是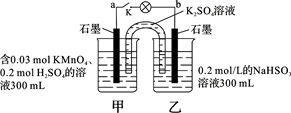
| A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1 |
| B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a |
| C.电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 |
| D.乙池中的氧化产物为SO42- |
下列表示对应化学反应或过程的离子方程式正确的是
| A.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
C.用石墨作电极电解AlCl3溶液:2Cl-+2H2O  Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
| D.亚硫酸氢钠溶液显酸性:NaHSO3=Na++H++ SO32- |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.0.1mol乙烯和乙醇的混合物完全燃烧所消耗的O2一定为0.3 NA |
| B.常温常压下,46 g NO2与N2O4的混合气体中含有的分子总数为NA |
| C.25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0 .1 NA |
| D.一定量的钠与8g氧气作用,若两者均无剩余,转移NA个电子 |