原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中不正确的是( )
| A.X能形成化学式为X(OH)3的碱 |
| B.X能与某些金属元素形成化合物 |
| C.X原子的最外层电子数和核电荷数肯定为奇数 |
| D.X可能形成化学式为KXO3的盐 |
有下列物质:① NaOH固体;② 浓硫酸;③ NH4NO3晶体;④ CaO固体。现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如图所示状态,判断加入的物质可能是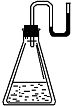
| A.①②③④ | B.①②④ | C.②③④ | D.①②③ |
下列大小关系的比较错误的是
| A.PH相同的盐酸和醋酸加水稀释相同倍数后,PH前者大于后者; |
| B.等质量的固态硫与硫蒸汽完全燃烧的反应热(ΔH),前者大于后者; |
C.温度、容积不变的密闭容器中2NO2 N2O4反应达到平衡,再充入N2O4气体,NO2的转化率前者大于后者; N2O4反应达到平衡,再充入N2O4气体,NO2的转化率前者大于后者; |
| D.在相同条件下,2molH2和1molO2的能量的总和一定大于2mol水的能量的总和。 |
下列事实,不能用勒夏特列原理解释的是
| A.实验室常用排饱和食盐水的方法收集氯气 |
| B.工业合成氨控制温度在较高温度(500℃)进行 |
| C.在浓氨水中加入烧碱可用于实验室快速生氨 |
| D.工业上将二氧化硫转化为三氧化硫常通入过量空气 |
相同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:
A(g)+2B(g) 2C(g) ΔH =a kJ·mol-1。(a>0)
2C(g) ΔH =a kJ·mol-1。(a>0)
实验测得起始、平衡时的有关数据如下表所示,下列叙述错误的是
| 容器 编号 |
起始时各物质的物质的量/mol |
达到平衡时 体系能量的变化 |
||
| A |
B |
C |
||
| ① |
1 |
2 |
0 |
吸收热量:0.25 akJ |
| ② |
0.5 |
1 |
1 |
吸收热量:Q kJ |
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中C的体积分数均约为18%
C.容器②中达到平衡时吸收的热量Q=0.25a kJ
D.若其他条件不变,把容器①的体积改为2L,则平衡时吸收的热量小于0.25a kJ
在密闭容器中,mA(g)+bB(g)⇌pC(g)反应平衡时,测得 c(A)为 0.5mol•L‾1,温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得 c(A)为 0.3mol•L‾1,则下列判断中正确的是
A.平衡向正反应方向移动 B.物质C的体积分数增加
C.化学计量数:m+b<p D.物质B的转化率减小