已知热化学方程式(Q1,Q2均为正值):C(s)+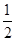 O2(g)=CO(g) ΔH=-Q1kJ·mol-1,C(s)+O2(g)=CO2(g) ΔH=-Q2 kJ·mol-1,有关上述反应的叙述错误的是( )
O2(g)=CO(g) ΔH=-Q1kJ·mol-1,C(s)+O2(g)=CO2(g) ΔH=-Q2 kJ·mol-1,有关上述反应的叙述错误的是( )
| A.Q1<Q2 |
| B.生成物总能量均高于反应物总能量 |
| C.由1 mol C反应生成1 mol CO气体时放出Q1 kJ热量 |
| D.1 mol CO2气体具有的能量大于1 mol干冰具有的能量 |
下列有关化学用语表示正确的是
A.H2S的电子式: |
B.基态氧原子的电子排布图: |
| C.二氧化硅的分子式:SiO2 |
| D.24Cr的电子排布式:[Ar]3d54s1 |
已知氯化铝易溶于苯和乙醚,其熔点为190℃,则下列结论正确的是
| A.氯化铝硬度大,固体可导电 | B.氯化铝易溶于有机溶剂,难溶于水 |
| C.氯化铝中存在离子键 | D.氯化铝属于分子晶体 |
下列关于电子云的说法中,正确的是
| A.电子云表示电子在原子核外运动的轨迹 |
| B.电子云表示电子在核外单位体积的空间出现的概率大小 |
| C.电子云界面图中的小黑点越密表示该核外空间的电子越多 |
| D.钠原子的1s、2s、3s电子云半径相同 |
NH3极易溶于水,与此性质无关的是
| A.NH3与水形成分子间氢键 | B.NH3是极性分子 |
| C.NH3相对分子质量小,范德华力小 | D.NH3会与水发生反应 |
下列说法中正确的是
| A.处于最低能量的原子叫做基态原子 |
| B.原子由基态变为激发态要产生发射光谱 |
| C.同一原子中,2p能级比3p能级的轨道数少 |
| D.3d轨道能量小于4s |