当前环境问题是一个全球重视的问题,引起环境问题的气体常见的有温室气体CO2、
污染性气体NOx、SOx等。如果对这些气体加以利用就可以成为重要的能源,既解决了对环境的污染,又解决了部分能源危机问题。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。CO2与H2反应制备CH3OH和H2O的化学方程式为
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。
已知:
①C(s)+O2(g)=CO2(g)ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g)ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g)ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式 。
(3)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)=2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是 。
X、Y、Z、W为常见含有相同电子数的离子或分子,其中X有5个原子核,这些微粒与一氧化氮间有如下转化关系(图中部分反应物、产物及反应条件已略去)。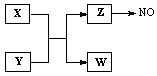
(1)Z →NO反应的化学方程式是:
液态 Z与水的电离相似,其中存在的电子数相同的两种微粒是。
(2)实验室中检验Z的化学试剂及现象是:
| 化学试剂 |
现象 |
|
| 方法一 |
||
| 方法二 |
(3)由构成X、Y的三种元素所组成的一种离子化合物,且三种元素原子数之比为2:4:3,该离子化合物是(填写化学式)。
(4)一定条件下,Z与一氧化氮或二氧化氮反应均可生成两种很稳定的产物。若有二氧化氮与Z的混合气体20 mL在该条件下反应,实际参加反应的二氧化氮比Z少2 mL,则原混合气体中Z与二氧化氮的体积比是。
A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为。
(2)由A、B、W三种元素组成的18电子微粒的电子式为。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式。
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放出氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是(标准状况下)。
(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为。
磷单质及其化合物的有广泛应用。
(1)三聚磷酸可视为三个磷酸分子(磷酸结构式见图)之间脱去两个分子产物,其结构式为。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为
(2)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为。
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)
(b)6H2PO2- +2H+ = 2P+4H2PO3-+3H2↑
某温度(T℃)时,测得0.01mol/LNaOH溶液的pH为11,则该温度下水的KW=____________。则该温度________(填“大于”、“小于”或“等于”)室温,其理由是_______________________________________________________________________。
此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得混合溶液为中性,且a=12,b=2,则Va∶Vb=________。
(2)若所得混合溶液为中性,且a+b=12,则Va∶Vb=________。
(3)若所得混合溶液的pH=10,且a=12,b=2,则Va∶Vb=__________。
工业上制取纯净的CuCl2·2H2O的主要过程是:①将粗氧化铜(含少量Fe)溶解于稀盐酸中。加热、过滤,调节滤液的pH为3;②对①所得滤液按下列步骤进行操作: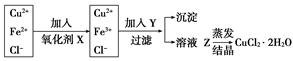
已知Cu2+、Fe2+在pH为4~5时不水解,而Fe3+却几乎完全水解而沉淀,请回答以下问题:
(1)X是________,其反应的离子方程式是___________________________________。
(2)Y物质应具备的条件是_________________,生产中Y可选______________________。
(3)溶液Z在蒸发结晶时应注意__________________________________________。