在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)  2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( )
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( )
| A.图中a点的值为0.15 |
| B.该反应的平衡常数K=0.03 |
| C.温度升高,平衡常数K值减小 |
| D.平衡时A2的转化率为62.5% |
实验室合成氨装置如图所示,则以下说法中错误的是( )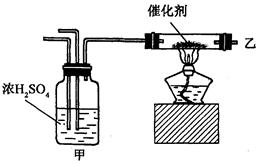
| A.装置甲的作用是干燥 |
| B.装置甲的作用是化合 |
C.乙处导出的气体是 , ,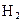 , ,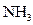 |
| D.检验产物的简单化学方法是用湿润的石蕊试纸或浓盐酸等 |
甲、乙两个相同的电解槽,如图所示连接a,b,c,d均为铂电极,通电后发现a极板处有气体放出,c极板质量增加,则以下说法中正确的是( )
A.甲槽中溶液是 ,乙槽中溶液是NaOH ,乙槽中溶液是NaOH |
B.甲槽中溶液是NaOH,乙槽中溶液是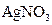 |
C.甲槽中溶液是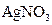 ,乙槽中溶液是 ,乙槽中溶液是 |
D.甲槽中溶液是 ,乙槽中溶液是 ,乙槽中溶液是 |
一种新型燃料电池,它是用两根金属做电极插入KOH溶液中,然后向两极上分别通甲烷和氧气,其电池反应为:
X极: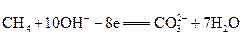
Y极: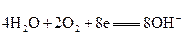
下列关于此燃料电池的有关说法中错误的是( )
| A.通过甲烷的电极(X)为电池的负极,通过氧气的电极(Y)为电池正极 |
| B.放电一段时间后,电解质溶液中KOH的物质的量改变 |
| C.在标准状况下,通过5.6L氧气,完全反应后有1.0mol的电子发生转移 |
| D.放电时,通过甲烷的一极附近的pH升高 |
扑热息痛是一种优良的解热镇痛药,结构式为 下列说法中正确的是( )
下列说法中正确的是( )
| A.它不与烧碱溶液反应 | B.它不能与浓溴水发生取代反应 |
| C.它不能被氧化剂氧化 | D.遇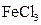 溶液发生显色反应 溶液发生显色反应 |
向2mL 0.5mol· 的
的 溶液中加入3mL 5mol·
溶液中加入3mL 5mol· KF溶液,发现
KF溶液,发现 溶液渐渐褪至无色,再加入KI溶液和
溶液渐渐褪至无色,再加入KI溶液和 振荡后,静置,不见
振荡后,静置,不见 层有紫红色,则下列说法正确的是( )
层有紫红色,则下列说法正确的是( )
A. 不与 不与 发生反应 发生反应 |
B. 与 与 结合成不与 结合成不与 反应的物质 反应的物质 |
C.F-使 的还原性减弱 的还原性减弱 |
D. 被F-还原为 被F-还原为 ,使溶液中不再存在 ,使溶液中不再存在 |