下列叙述正确的是( )
| A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| C.pH=11的NaOH的溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色 |
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中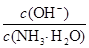 增大 增大 |
已知Cu+在酸性条件下能发生下列反应:Cu+ → Cu + Cu2+(未配平)。NH4CuSO3与足量的10mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成②有刺激性气味气体产生③溶液呈蓝色。据此判断下列说法一定合理的是
| A.气体是二氧化硫 | B.NH4CuSO3中铜元素全部被氧化 |
| C.反应后为硫酸铜溶液 | D.硫酸全部作氧化剂 |
一定温度下有可逆反应:A(g)+2B(g)  2C(g)+D(g) 。现将5molA和10molB加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示。
2C(g)+D(g) 。现将5molA和10molB加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示。
下列有关说法正确的是
| A.在0~5min内,正反应速率逐渐增大 |
| B.反应从起始至5min时,B的转化率为50% |
| C.5min时的平衡常数与10min时的平衡常数不等 |
| D.第15min时,B的体积分数为25% |
向一洁净干燥的烧杯中加入44.4gAl粉与Fe粉混合物,然后加入过量的盐酸,产生标况下气体26.88L。若将该混合物加入500mL14 mol·L-1的HNO3中(不考虑发生钝化),产生的气体(标准状况下测定)如图所示,假设HNO3的还原产物为NO与NO2,那么理论上从哪一时刻开始产生NO气体?(假设浓度小于9mol/L为稀HNO3)
| A.t1 | B.t2 | C.t3 | D.t4 |
甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列说法正确的是
| A.若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3 |
B.若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,则反应①的化学方程式4NH3+5O2 4NO+6H2O 4NO+6H2O |
| C.若甲、乙、丙的溶液显碱性,丙可作为医疗上治疗胃酸过多症的药剂,将等物质的量的乙和丙溶于水形成混合溶液,溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)> c(H+) |
| D.若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐 |

 有多种同分异构体,其中符合属于酯类并含有苯环的同分异构体有多少种(不考虑立体异构)?
有多种同分异构体,其中符合属于酯类并含有苯环的同分异构体有多少种(不考虑立体异构)?
| A.6种 | B.5种 | C.4种 | D.3种 |