活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):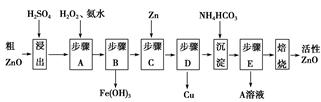
已知:几种离子生成氢氧化物沉淀时的pH如表:
| 待沉淀离子 |
Fe2+ |
Fe3+ |
Zn2+ |
Cu2+ |
| 开始沉淀时pH |
6.34 |
1.48 |
6.2 |
5.2 |
| 完全沉淀时pH |
9.7 |
3.2 |
8.0 |
6.4 |
请回答下列问题:
(1)步骤A加H2O2发生反应的离子方程式是 ,该步骤需控制溶液pH的范围是 。
(2)A溶液中主要含有的溶质是 。
(3)碱式碳酸锌经焙烧制得活性ZnO的反应ΔH>0,该反应能自发进行的原因是ΔS (选填“=”、“>”或“<”)0。
(4)若经处理后的废水pH=8,此时Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
I:(1)氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ·g-1。请写出氢气燃烧的热化学方程式。
(2)1molN2(g)和1molO2(g)在一定条件下反应生成2molNO(g),吸收180kJ的热量,已知断裂1molN2(g)中的N≡N和1molO2(g)中的O=O分别需要吸收946kJ和498kJ的能量,则1molNO分子中的化学键形成时可释放_______kJ的能量。
Ⅱ:在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,如图所示: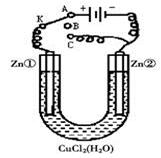
(1)如果把电键K接A,这一装置形成装置,Zn①极是_____极,其电极反应式是_______________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成________装置,Zn②极是_______极,其电极反应式是____________________;
(3)上述装置进行2min后,再转换电键K到B,在Zn②极上发生的腐蚀属于,Zn①极发生的腐蚀主要属于。
下表为元素周期表的一部分,元素①-⑦是短周期的主族元素,请参照元素①-⑦在表中的位置,回答下列问题:
| ① |
② |
|||||
| ③ |
④ |
⑤ |
⑥ |
⑦ |
(1)写出⑥在元素周期表中的位置。
(2)②的气态氢化物的沸点⑥的气态氢化物的沸点。(填大于、小于或等于)
写出由②、③两种元素组成的化合物的电子式。
(3)④的最高价氧化物与③的最高价氧化物对应的水化物的水溶液反应的离子方程式为
。
(4)①和⑤形成的化合物是化工行业已合成的一种硬度很大、熔点很高的晶体,若已知在此化合物中各元素均处于其最高或最低价态,据此推断:该化合物的化学式可能是,与该化合物晶体类型相同的是(请用相应的编号填写)。

A B C
(5)由①和③形成的化合物甲和乙,甲受到撞击会分解生成一种固体单质和一种气体单质,此反应中反应物、固体单质和气体单质的物质的量之比是2:2:3;乙中加入过量的盐酸后生成两种盐,在其中一种盐中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体。则化合物甲的化学式为,化合物乙与过量盐酸反应的化学方程式为。
一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中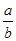 ="_________"
="_________"
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:
____________
(3)下列叙述中能说明上述反应达到平衡状态的是
| A.反应中M与N的物质的量之比为1︰1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内每消耗a mol N,同时生成b mol M |
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
有下列晶体:①冰②金刚石③氩④过氧化钠⑤二氧化硅⑥氯化镁⑦纯醋酸
⑧白磷⑨氯化铵⑩金属铝。用序号回答下列问题:
(1)不含任何化学键的物质是 ;(2)只含有极性共价键的分子晶体是 ;
(3)固态时,晶体中只含有范德华力的是;(4)含共价键的离子晶体是 ;
(5)只含有离子键的离子晶体是_______;(6)只含有非极性键的原子晶体是_________;
(7)在一定条件下能导电而不发生化学变化的是。
已知下图中B是空气中含量最多的物质, F为一强酸: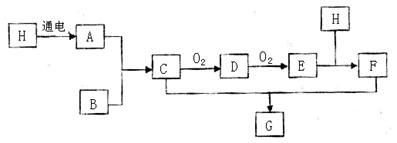
(1)C的化学式是。
(2)D和E都是大气污染物,两种物质相互转化的化学方程式分别是:
①D→E。
②E→D。
(3)E和H的反应中,氧化剂和还原剂的质量比是。
(4)C和F反应生成G的化学方程式是。