下列防腐措施中,利用原电池反应使主要金属得到保护的是( )
| A.用氧化剂使金属表面生成致密稳定的氧化物保护膜 |
| B.在金属中加入一些铬或镍制成合金 |
| C.在轮船的壳体水线以下部分装上锌锭 |
| D.金属表面喷漆 |
有关如图所示原电池(盐桥中装有含琼脂的KCl饱和溶液)的叙述,正确的是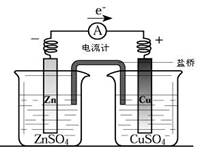
| A.铜是阳极,铜片上有气泡产生 |
| B.铜离子在铜片表面被还原 |
| C.电流从锌片经导线流向铜片 |
| D.反应中,盐桥中的K+会移向ZnSO4溶液 |
钢铁发生吸氧腐蚀时,正极上发生的电极反应是
| A.2H++2e— ===H2 ↑ | B.Fe-2e—===Fe2+ |
| C.2H2O+O2+4e— ===4OH— | D.Fe-3e—===Fe3+ |
为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是
| A.将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同 |
| B.盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 |
| C.将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快 |
| D.升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物能量一定低于反应物总能量 |
| B.放热反应不必加热就一定能发生 |
| C.应用盖斯定律,可计算某些难以直接测量的反应的焓变 |
| D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件的ΔH不同 |
下列叙述正确的是
| A.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 |
| B.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” |
| C.废电池需回收,主要是要利用电池外壳的金属材料 |
| D.升高温度可降低活化能 |