电解100 mL含c(H+)=0.30 mol·L-1下列溶液,当电路中通过0.04 mol
电子时,理论上析出金属质量最大的是( )
| A.0.10 mol·L-1AgNO3溶液 |
| B.0.10 mol·L-1ZnSO4溶液 |
| C.0.20 mol·L-1CuCl2溶液 |
| D.0.20 mol·L-1Pb(NO3)2溶液 |
下列事实可证明氨水是弱碱的是
| A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 | B.铵盐受热易分解 |
| C.0.1mol/L氨水可以使酚酞试液变红 | D.0.1mol/L氯化铵溶液的pH为5 |
25℃时,在浓度均为1 mol/L 的NH4Cl、NH4HCO3、NH4HSO4溶液中,测得其中c(NH4+)分别为 a、b、c(mol/L),则下列判断正确的是
| A.a>b>c | B.c>a>b | C.b>a>c | D.a>c>b |
在相同温度下,在水中分别加入下列物质,若用Kw表示水的离子积,a表示水的电离度(已电离的水分子与全部水分子的物质的量之比),则能使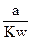 值增大的是
值增大的是
| A.Na2CO3 | B.NaHSO4 | C.NaOH | D.NaCl |
将0.02 mol/L的HCN溶液与0.02 mol/ L的NaCN溶液等体积混合,测得混合溶液中的
c (CN – ) < c (Na +),则下列关系中不正确的是
| A.c (Na+) >c (CN –) >c (OH –) >c (H+) |
| B.c (HCN) + c (CN –) =" 0.02" mol/ L |
| C.c (CN – ) > c (HCN) |
| D.c (Na+) + c (H+) =" c" (CN – ) + c (OH – ) |
pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是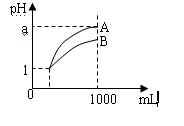
A、A、B两种酸溶液的物质的量浓度一定相等
B、稀释后,A酸溶液的酸性比B酸溶液强;
C、若a = 4,则B是强酸,A是弱酸;
D、若1< a < 4,则A、B都是弱酸。