以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下: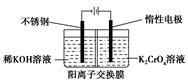
下列说法不正确的是( )
| A.在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑ |
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+ Cr2O72-+H2O向右移动 Cr2O72-+H2O向右移动 |
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑ 2K2Cr2O7+4KOH+2H2↑+O2↑ |
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nk/nCr)为d,则此时铬酸钾的转化率为1-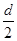 |
向一个小烧杯中加入20克蔗糖,加3~4滴水,再加入20ml浓硫酸,观察到的实验现象是:烧杯发热、蔗糖变黑、体积膨胀,变成疏松多孔的海棉状的炭,并放出有制激性气味的气体。这个过程中浓硫酸没有表现出的性质是( )
| A.吸水性 | B.脱水性 | C.强氧化性 | D.酸性 |
下列离子方程式正确的是( )
| A.实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O |
| B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| C.氯化铝溶液加入氨水:Al3++3OH-=Al(OH)3↓ |
D.用氢氧化钠检验氯化铵溶液中铵根离子:NH4++OH― NH3↑+H2O NH3↑+H2O |
下列结论可靠的是( )
A.试液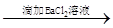 白色沉淀 白色沉淀 沉淀不溶解 结论:试液中一定含SO42- 沉淀不溶解 结论:试液中一定含SO42- |
B.气体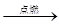 无色气体 无色气体 白色沉淀结论:原气体一定是CO 白色沉淀结论:原气体一定是CO |
C.溶液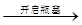 冒白雾 冒白雾 白烟结论:原溶液一定是浓盐酸 白烟结论:原溶液一定是浓盐酸 |
D.有色溶液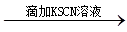 变红色结论:原溶液中一定含Fe3+ 变红色结论:原溶液中一定含Fe3+ |
下列反应的离子方程式正确的是( )
| A.铁和稀盐酸反应2Fe+6H+=2Fe3++3H2↑ |
| B.碳酸钙溶于稀盐酸中 CO32-+2H+=CO2↑+H2O |
| C.碳酸氢钠溶液与盐酸反应HCO3-+H+=CO2↑+H2O |
| D.氧化铜与盐酸反应 O2―+2H+=H2O |
下列五种有色溶液与SO2作用,均能褪色,其反应实质相同的是( )
①品红溶液②酸性KMnO4溶液③溴水④滴入酚酞的烧碱溶液⑤淀粉—碘溶液
| A.①②③ | B.②③④ | C.③④⑤ | D.②③⑤ |