某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。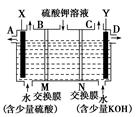
(1)X极与电源的 (填“正”或“负”)极相连,氢气从 (选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为 (填“阴离子”或“阳离子”,下同)交换膜,N为 交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为 。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是 ,转移的电子数为 。
已知:乙醛在一定条件下可被氧气氧化为乙酸。A是石油裂解主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物之间的转化关系:
(1)A的结构简式为,可以作为水果的;
(2)B+D→E的反应类型为;
(3)写出B→C和B+D→E的两个化学反应方程式:
B→C:,
B+D→E:;
(4)如何除去E中所混有少量的D杂质,简述操作过程:。
根据下列要求,从①H2O②CH2=CH2③ HNO3④溴水⑤CH3CH2OH⑥ (C6H10O5)n中选择恰当的反应物(用序号填写),并写出对应的化学方程式及反应类型。
请按要求回答下列问题:
(1)盛放烧碱液的试剂瓶不能用玻璃塞,是为了防止发生反应(用化学方程式表示),而使瓶塞与瓶口粘在一起;
(2)铝热反应在工业生产中的重要用途之一是;
(3)“ 硅材料”又被称为信息材料。其中广泛用于光导纤维的材料是(填化学式,下同);广泛用于制造集成电路的材料是;
醋柳酯是一种镇咳祛痰药。用于上呼吸道感染、感冒咳嗽、急慢性支气管炎症等的治疗,其结构简式如右。回答下列问题:
(1)醋柳酯的分子式为。
(2)关于醋柳酯说法正确的是为()
| A.是高分子化合物 | B.可与氢气发生加成反应 |
| C.不能发生银镜反应 | D.能发生水解反应且只生成2种有机物 |
(3)醋柳酯可由下图所示路线合成
①中间产品C中混有反应物A和B,检验C中含有A的反应可以是(用化学反应方程式表示)
②写出C和足量NaOH溶液反应的化学方程
③A的同分异构体很多,写出属于酯类,且能与FeCl3反应显紫色的同分异构体的结构简式。
已知某有机物的结构简式为:
(1)该有机物中所含官能团的名称是____________、___________________。
(2)该有机物发生加成聚合反应后,所得产物的结构简式为______________。
(3)写出该有机物发生消去反应的化学方程式(注明反应条件):
。