如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极。电解过程中,发 现石墨电极附近先变红。请回答: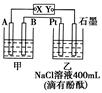
(1)电源X极为 极(填“正”或“负”),乙池中Pt电极上的电极反应式为 。
(2)甲池若为电解精炼铜的装置,其阴极增重12.8 g,则乙池中阴极上放出的气体在标准状况下的体积为 ,电路中通过的电子为 mol。
(3)在(2)的情况下,若乙池剩余溶液的体积仍为400 mL,则电解后所得溶液c(OH-)= 。
恒温恒容下,将2 mol A气体和2 mol B气体通入体积为2 L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为________。
(2)x=________。
(3)A的转化率与B的转化率之比为________。
已知:①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;
②2CH3CHO+O2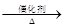 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下:
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下: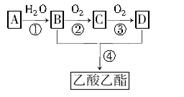
回答下列问题:
(1)A的空间构型是___________________。
(2)A、C分子中的官能团名称分别是___________、__________;
(3)写出下列反应的反应类型:①___________________②___________________,
(4)写出下列反应的化学方程式:
①___________________________________________;
②___________________________________________;
④___________________________________________;
A、B、C为短周期元素,在周期表中所处的位置如图所示。
| A |
C |
|
| B |
A、C两种元素的原子核外电子数之和等于B原子的质子数,B2-的结构示意图为:
请回答下列问题:
(1)写出A、B、C三种元素的符号:A,B,C。
(2)B位于周期表中第周期族。
(3)C的氢化物的电子式为;A的最高价氧化物对应水化物的化学式为。
(4)BC6作制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂。已知BC6在温度高于45度时为气态。BC6属于(填“离子”或“共价”)化合物。
浙江东方化工厂生产的某产品只含C、H、O三种元素,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等)。
(1)该产品的结构简式为:,
(2)在一定条件下,该产品跟乙二醇反应可得到分子式为C6 H10O3的物质,该物质发生加聚反应可得到用来制作隐形眼镜的高分子材料,这种高聚物的结构简式为:。
(3)某物质M与该产品互为同分异构体,M具有下列性质:①可发生水解反应,②能使酸性高锰酸钾溶液褪色,③M为链状有机物。写出M可能的结构简式(至少写3个)
按要求完成下列试题
(1)根据系统命名法(IUPAC)命名(CH3CH2)2C(CH3)2;
(2)写出2,3-二甲基-1-丁烯的结构简式;
(3)写出丙醛和新制的氢氧化铜溶液共热的化学反应方程式;