H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9]。下列说法正确的是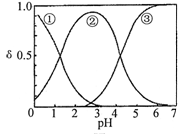
| A.曲线①代表的粒子是HC2O4- |
| B.0.1 mol·L-1 NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) |
| C.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) |
| D.一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变 |
23592U和23892U是铀的两种主要的同位素。U是制造原子弹和核反应堆的主要原料。下列有关说法正确的是
| A.U原子核中含有92个中子 |
| B.U原子核外有143个电子 |
| C.23592U和23892U互为同位素 |
| D.23592U和23892U互为同素异形体 |
下列表示物质或微粒的化学用语正确的是
| A.氮分子的结构式:N—N |
B.Mg2+的结构示意图: |
C.二氧化碳电子式:  |
| D.钙离子的电子式:Ca2+ |
下列有关能源与能量的说法正确的是
| A.煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源 |
| B.蒸汽属于一次能源 |
| C.凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应 |
| D.反应物和生成物的总能量的相对大小决定反应是放热还是吸热 |
[选修3—物质结构与性质]下列物质的结构或性质与氢键无关的是
| A.乙醚的沸点 | B.乙醇在水中的溶解度 |
| C.氢化镁的晶格能 | D.DNA的双螺旋结构 |
[化学——选修5:有机化学基础]下列有机物的命名错误的是