“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
| A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 |
| B.加热时,②、③中的溶液均变红,冷却后又都变为无色 |
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅(已知:2NO2(g) N2O4(g)△H<0) N2O4(g)△H<0) |
| D.四个“封管实验”中都有可逆反应发生 |
在下列各组反应中,两者反应遵循的化学原理相同的是
| A.KClO3+6HClKCl+3Cl2↑+3H2O和2Na2S+3H2SO3===2Na2SO3+3S↓+3H2O |
| B.稀硫酸溶解FeO和稀硝酸溶解FeO |
| C.过氧化钠的漂白性和SO2水溶液的漂白性 |
| D.泡沫灭火器灭火和干粉灭火器灭火 |
与pH类似,我们定义pOH=-lgc(OH-),下列溶液,一定呈中性的是
| A.c(H+)=1×10-7mol·L-1的溶液 |
| B.水电离的H+和OH-浓度相等的溶液 |
| C.pH+pOH=14的溶液 |
| D.pH=pOH的溶液 |
在密闭容器中进行以下可逆反应:A(g)+B(g) C(g)+2D(?),在不同的条件下C的百分含量的变化情况如右图,则该反应描述正确的是
C(g)+2D(?),在不同的条件下C的百分含量的变化情况如右图,则该反应描述正确的是
| A.正反应放热,D是固体 |
| B.正反应放热,D是气体 |
| C.正反应吸热,D是气体 |
| D.正反应放热,D是固体或气体 |
如图是关于N2+3H2 2NH3 ΔH<0的速率—时间图象,则t1时刻使平衡发生移动的原因是
2NH3 ΔH<0的速率—时间图象,则t1时刻使平衡发生移动的原因是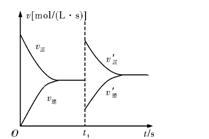
| A.升高温度,同时增大压强 |
| B.降低温度,同时减小压强 |
| C.增大反应物的浓度,同时使用适宜的催化剂 |
| D.增大反应物的浓度,同时减小生成物的浓度 |
下列离子方程式正确的是
| A.向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2===2Fe3++2Cl- |
| B.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O―→2C6H5OH+CO |
| C.向硫酸氢钠溶液中滴入氢氧化钡溶液至中性:H++SO+Ba2++OH-===BaSO4↓+H2O |
| D.将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+===Fe3++3H2O |