汞(熔点-39℃,沸点356℃)是制造电池、电极等的重要原料,历史上曾用“灼烧辰砂法”制取汞。目前工业上制粗汞的一种流程图如下。
下列分析错误的是( )
A.“灼烧辰砂法”过程中电子转移的方向和数目可表示为: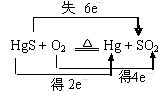 |
| B.辰砂与氧化钙加热反应时,CaSO4为氧化产物 |
| C.洗涤粗汞可用5%的盐酸代替5%的硝酸 |
| D.减压蒸馏的目的是降低汞的沸点,提高分离效率 |
在卤代烃RCH2CH2X中化学键如下图,则下
列说法中正确的是( )
| A.当该卤代烃发生水解反应时,被破坏的键是①和③ |
| B.当该卤代烃发生消去反应时,被破坏的键是①和③ |
| C.当该卤代烃发生水解反应时,被破坏的键是③ |
| D.当该卤代烃发生消去反应时,被破坏的键是①和② |
下列反应不属于取代反应的是( )
| A.溴乙烷与氢氧化钠水溶液共热 | B.溴乙烷与氢氧化钠的乙醇溶液共热 |
| C.甲烷与氯气 | D.苯在催化剂作用下能与液溴发生取代反应 |
某学生做乙醛还原性的实验,取l mol/L的硫酸铜溶液2 mL和0.4mol/L的氢氧化钠溶液 4 mL,在一支试管里混合后加入0.5 mL 40%的乙醛溶液加热至沸腾,无红色沉淀,实验失败的原因是( )
| A.氧氧化钠的量不够 | B.硫酸铜不够量 |
| C.乙醛溶液太少 | D.加热时间不够 |
某草药中有一种色素,它的结构简式为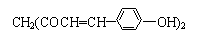 ,用它制成的试剂可以检验物质的酸碱性。能够跟1 mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
,用它制成的试剂可以检验物质的酸碱性。能够跟1 mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
| A.3 mol、5 mol | B.6 mol、8 mol |
| C.10 mol、8 mol | D.6 mol、10 mol |
某有机物的结构简式如图所示,则此有机物可发生反应的类型可能有①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥中和 ⑦氧化 ⑧加聚,其中组合正确的是( )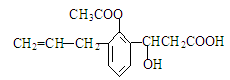
| A.①②③⑤⑥ |
| B.②③④⑤⑥ |
| C.①②③④⑤⑥ |
| D.全部 |