在容积为2 L的3个密闭容器中发生反应3A(g)+B(g) xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol A、2 mol B |
6 mol A、4 mol B |
2 mol C |
| 到达平衡的时间(min) |
5 |
|
8 |
| A的浓度(mol/L) |
c1 |
c2 |
|
| C的体积分数 |
w1 |
|
w3 |
| 混合气体密度(g/L) |
ρ1 |
ρ2 |
|
下列说法正确的是( )
A.若x<4,则2c1<c2
B.若w3=w1,可断定x=4
C.无论x的值是多少,均有2ρ1=ρ2
D.容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol·L-1·min-1
实验室进行过滤和蒸发操作时,都要用到的仪器是()
| A.玻璃棒 | B.量筒 | C.蒸发皿 | D.酒精灯 |
我国著名的化工专家候德榜在20世纪20年代所创立的“候氏制碱法”誉满全球,“候氏制碱法”中的碱是指下列的
| A.NaOH | B.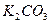 |
C.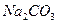 |
D.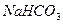 |
将a mol Na和amol Al一同投入m g足量水中,所得溶液密度为dg·㎝-3,该溶液的质量分数为
| A.82a /(46a + m)% | B.82000a /(46a + 2m)% |
| C.8200a /(46a + m)% | D.8200a /(69a +2 m)% |
在一定温度下碳酸钠的溶解度为40g,向280g的饱和碳酸钠溶液中加入10.6g无水碳酸钠,搅拌静置,最终所得晶体(Na2CO3·10H2O)的质量为
| A.10.6g | B.60.6g | C.28.6g | D.89.2g |
取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是
| A.1:1:2 | B.2:1:3 | C.6:3:2 | D.3:2:1 |