实验室制备苯甲醇和苯甲酸的化学原理是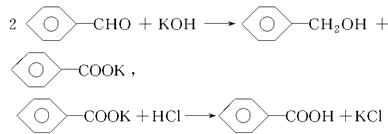
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃,苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
试根据上述信息,判断以下说法错误的是( )
| A.操作Ⅰ是萃取分液 |
| B.乙醚溶液中所溶解的主要成分是苯甲醇 |
| C.操作Ⅱ蒸馏所得产品甲是苯甲醇 |
| D.操作Ⅲ过滤得到产品乙是苯甲酸钾 |
有一种新型燃料电池,工作时在一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。现用该燃料电池和惰性电极电解Na2SO4溶液一段时间,假设电解时温度不变,下列说法不正确的是
| A.在熔融电解质中,O2-由正极移向负极 |
| B.电解一共生成0.9 mol气体时,理论上消耗0.1 mol丁烷 |
| C.电解池的阳极反应式为4OH--4e-===2H2O+O2↑ |
| D.通入空气的一极是正极,电极反应式为O2+4e-===2O2- |
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物。下列有关判断正确的是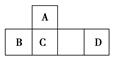
A.简单氢化物的热稳定性:C>A
B.最高价氧化物对应水化物的酸性:D<C
C.B的最高价氧化物的水化物能与C的最高价氧化物的水化物反应
D.A、C、D的含氧酸的钠盐水溶液可能均显碱性
下列判断中,正确的是
| A.已知25 ℃时NH4CN显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN) |
| B.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小 |
| C.pH试纸测得新制氯水的pH为4 |
| D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
实验法和比较法是研究物质性质的基本方法。以下实验设计中不合理或不严密的是
| A.钠和镁分别与冷水反应,判断钠和镁的金属性强弱 |
| B.测定相同温度下盐酸和醋酸溶液的pH,就可证明盐酸是强酸、醋酸是弱酸 |
| C.铁分别与氯气和硫反应,判断氯气与硫的氧化性强弱 |
| D.测定相同条件下Na2CO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱 |
室温下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法错误的是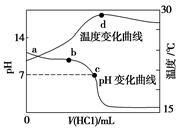
| A.a、d两点的溶液,水的离子积Kw(a)>Kw(d) |
| B.将此氨水稀释,溶液的导电能力减弱 |
| C.c点时消耗盐酸体积V(HCl)<20 mL |
D.室温下,a点的氨水电离常数为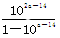 mol·L-1 mol·L-1 |