某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL; |
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写) 。
(2)上述B步骤操作的目的是 。
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果 (填“偏高”“偏低”或“不变”)。
(4)判断到达滴定终点的实验现象是 。
牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡: Ca5(PO4)3OH(固)
Ca5(PO4)3OH(固)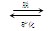 5Ca2++3PO43-+OH-
5Ca2++3PO43-+OH-
(1)进食后,细菌和酶作用于食物,产生有机酸,这时牙齿受腐蚀,其原因是。
(2)已知Ca(PO4)3F(固)的溶解度比上面的矿化产物更小,质地更坚固。请用离子方程式表示:
(3)当牙膏中配有氟化物添加剂后能防止龋牙的原因。
(4)根据以上原理,请你提出一种其他促进矿化的办法:。
通过实验测定反应速率的方法有多种,如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的__________来实现;在KMnO4与H2C2O4反应中,可通过测定________来测定该反应的速率;在Na2S2O3和H2SO4反应中,该反应的速率可通过___________________来测定。
将下列性质的番号,填入各小题后面对应的括号中:
| A.脱水性; | B.强酸性; | C.二元酸; | D.氧化性;(E)吸水性 |
(1)将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。()
(2)NaOH与H2SO4反应,可生成Na2SO4和NaHSO4这两种盐。()
(3)在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。()
(4)在稀HNO3中放入铝片就产生NO。()
(5)在稀H2SO4中放入铝片就产生H2。()
(6)在冷浓HNO3中放入铝片没明显现象。()
(7)浓H2SO4敞口久置会增重。()
(8)用稀硫酸清洗金属表面的氧化物()
在第3周期中,置换酸中氢的能力最强的元素的元素符号为,化学性质最稳定的元素符号是,最高价氧化物的水化物的酸性最强的化合物的化学式是,碱性最强的化合物的化学式是,显两性的氢氧化物的化学式是,该两性氢氧化物与盐酸、氢氧钠溶液分别反应的离子方程式为
、,原子半径最大的金属元素的名称是,离子半径最小的离子结构示意图是
有A、B、C、D、E五种元素,元素A的一种原子无中子,元素B和C都有2个电子层,它们能生成无色无嗅的气体BC2,元素D有三个电子层,它和元素C属于同一主族,D和C生成有刺激性气味的气体DC2;元素E的阳离子E+的电子层结构与Ar的电子层结构相同,试回答:
(1)它们的元素符号是:A________B________C________D________E________。
( 2)A和D的化合物与C和D的化合物(DC2)能否反应?若能反应写出反应方程式