已知0.1 mol·L-1的二元酸H2A溶液的pH=4,则下列说法中正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
二茂铁分子[Fe (C5H5)2]是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法正确的是()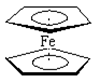
| A.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为离子键 |
B.1mol环戊二烯(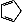 )中含有σ键的数目为5NA )中含有σ键的数目为5NA |
| C.二茂铁分子中存在π键 |
| D.Fe2+的电子排布式为1s22s22p63s23p63d44s2 |
下列有关含氧酸的说法中正确的是()
| A.元素的非金属性越强,其含氧酸的酸性就越强 |
| B.含氧酸中有多少个H原子,就属于几元酸 |
| C.同一元素的不同含氧酸,非羟基氧越多,该酸的酸性越强 |
| D.含氧酸中,中心原子的化合价越高,其氧化性一定越强 |
某烷烃主链为4个碳原子的同分异构体有2种,则含相同碳原子数、主链也为4个碳原子的烯烃同分异构体有()种?
| A.4 | B.3 | C.5 | D.2 |
外围电子构型为4f75d16s2元素在周期表中的位置是()
| A.四周期ⅦB族 | B.五周期ⅢB族 |
| C.六周期ⅦB族 | D.六周期ⅢB族 |
以NA表示阿伏加德罗常数的值,下列说法正确的是()
| A.124 g P4含有P—P键的个数为4NA | B.1mol冰中含氢键数为4NA |
| C.22.4LCH4的分子数为NA | D.26g C2H2中有2NA个π键 |