某温度下 ,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示,据图分析,下列判断错误的是( )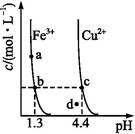
| A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2] |
| B.加适量NH4Cl固体可使溶液由a点变到b点 |
| C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
| D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
(原创)下列说法不正确的是( )
| A.中和热测定实验中,应迅速将NaOH溶液和盐酸在测定装置中混合 |
| B.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 |
| C.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL 5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象 |
D.已知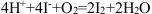 ,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol·L-1KI溶液、0.1 mol·L-1稀硫酸外,还需要用到淀粉溶液 ,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol·L-1KI溶液、0.1 mol·L-1稀硫酸外,还需要用到淀粉溶液 |
有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
| A.V3=V2=V1 | B.V3>V2=V1 | C.V1=V2>V3 | D.V3>V2>V1 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色溶液中: |
B.能使石蕊呈蓝色的溶液中: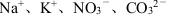 |
C.c (H+ )/ c(OH -)=1012 的溶液中: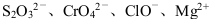 |
D.水电离的c (H)=10-12 mol·L-1的溶液中: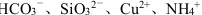 |
下列事实中,能证实一元酸HR是弱电解质的是( )
| A.HR溶液和KCl溶液不发生反应 |
| B.能与水以任意比例互溶 |
| C.0.1 mol·L-1的HR溶液中c(R- ) ="0.01" mol·L-1 |
| D.HR属于共价化合物 |
下列化学用语正确的是( )
A.NaHCO3的电离: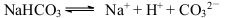 |
B.HS- 的电离:HS—+H2O H3O++S2- H3O++S2- |
C.H3PO4的电离: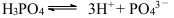 |
D.熔融状态下NaHSO4的电离: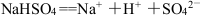 |