CaCl2常用于冬季道路除雪,建筑工业的防冻等,实验室常用作干燥剂。工业上常用大理石(含有少量Al3+、Fe2+、Fe3+等杂质)来制备。下图为实验室模拟其工艺流程:
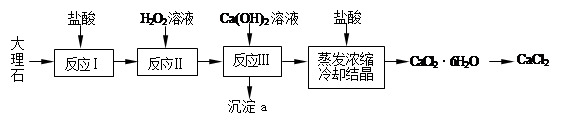
已知:常温下,溶液中的Fe3+、Al3+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,4,9.7。
(1)写出反应Ⅰ中主要反应的离子方程式: 。
(2)反应Ⅱ中的化学方程式: 。
(3)反应Ⅲ中必须控制加入Ca(OH)2的量,使溶液的pH约为8.0,此时沉淀a的成分为: ,若pH过大,则可能发生副反应的离子方程式: 。
(4)实验用所示装置进行反应Ⅰ时,利用制取CO2进行有关性质实验,

①若烧杯中溶液为硅酸钠,则实验现象为
②若烧杯中溶液为偏铝酸钠溶液,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
白磷(P4)分子为正四面体型分子,如图所示,4个P原子位于正四面体的四个顶点,请回答下列问题: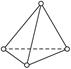
(1)分子中P—P键之间的夹角为__________;
(2)1 mol P4分子中有__________mol P—P键;
(3)P4分子是__________(填极性或非极性)分子。
已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。试完成下列问题。(1)写出五种元素的名称。
A__________,B__________,C__________,D__________,E__________。
(2)用电子式表示离子化合物A2B的形成过程____________________。
(3)写出D元素形成的单质的结构式__________。
(4)写出下列物质的电子式。
E和B形成的化合物__________;A、B、E形成的化合物__________;D、E形成的化合物__________。
(5)A、B两元素组成的化合物A2B2属于__________(选“离子”“共价”)化合物,存在的化学键是__________,写出A2B2与水反应的化学方程式______________________________。
已知有关物质的熔、沸点数据如表:
| 物质 |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
| 熔点/℃ |
2 852 |
2 072 |
714 |
190(2.5×105 Pa) |
| 沸点/℃ |
3 600 |
2 980 |
1 412 |
182.7 |
请参考上述数据填空和完成问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?______________________________。
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是_______________。
金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图)。金原子的直径为d,用Na表示阿伏加德罗常数,M表示金的摩尔质量。
(1)金晶体每个晶胞中含有__________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定____________________。
(3)一个晶胞的体积是多少?
(4)金晶体的密度是多少?
金和铜可以形成多种金属化合物,其中一种的晶体结构如图所示(为面心立方结构)。
(1)该金属化合物的化学式__________。
(2)已知Au的相对原子质量为197,Cu的相对原子质量为64,阿伏加德罗常数为Na mol-1,若该化合物的密度为d g·cm-3,试计算两个最近金原子的核间距。