目前雾霾现象较严重,某些燃料的过度使用是原因之一,有人提出二甲醚是一种重要的清洁燃料。工业上可利用煤的气化产物合成二甲醚。请回答下列问题:
(1) 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)+CO(g) CH3OH(g); ΔH=-90.8kJ·mol-1
CH3OH(g); ΔH=-90.8kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+H2O(g); ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g); ΔH=-23.5kJ·mol-1
③ CO(g)+H2O(g) CO2(g)+H2(g); ΔH=-41.3kJ·mol-1
CO2(g)+H2(g); ΔH=-41.3kJ·mol-1
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH= ;
CH3OCH3(g)+CO2(g)的ΔH= ;
(2)工业上还可利用上述反应中的CO2和H2合成二甲醚反应如下:
6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知该反应平衡常数(K)与温度(T)的关系如图所示:

①该反应的平衡常数表达式为 。
②若升高温度,则平衡向 反应方向移动(填“正”或“逆”)
③一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应
达到化学平衡状态的是 (选填编号)。
a.c(H2)与c(H2O)的比值保持不变 b.单位时间内有2mol H2消耗时有t mol H2O生成
c.容器中气体密度不再改变 d.容器中气体压强不再改变
(3) 氢能源是理想的能源,是治理雾霾现象的途径之一。
①用丙烷和水为原料在电催化下制氢气,同时得到一种含有单三元环的环氧化合物A,该反应的化学方程式为 ; 该反应也可生成A的同分异构体——另一种环氧化合物B,B的核磁共振氢谱为下图中的 (填“a”或“b”)。

②已知叠氮酸(HN3)不稳定,同时也能与活泼金属反应,反应方程式为:
2HN3=3N2↑+H2↑
2HN3+Zn=Zn(N3)2+H2↑
0.2mol HN3与一定量Zn完全反应,在标准状况下生成6.72L气体,其中被金属锌还原HN3物质的
量为 。
某河道两旁有甲、乙两个化工厂。它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。
(1)经测定甲厂的废水明显呈酸性,故乙厂废水中所含的三种离子应该是 。
(2)如果要回收废水中的金属银,可以在废水中加入过量的一种常见金属,反应后的溶液中只含一种金属阳离子,过滤所得固体的成分是,要进一步分离出银,方法是。
(3)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出生成红褐色沉淀的离子方程式是:。
在一条鱼虾几乎绝迹的小河边从上游到下游依次有四座工厂,甲,乙,丙,丁四厂排放的废液中含有Na2CO3,FeCl3,Ca(OH)2,HCl中的一种;某中学环保小组对河水检测时发现:甲处河水呈乳白色,乙处河水呈红褐色,丙处河水变浑浊,丁处产生气泡,河水仍然澄清,试回答:
(1)四处河水排放的污染物分别是:甲_,乙____,丙,丁。
(2)在丁处的下游取出的河水中,肯定含有的离子是。
(3)小河中鱼虾绝迹的原因是:。
为了对某工厂排出的废水水质进行监测,某化学实验室取500 mL水样进行检测。当向其中加入KSCN溶液时,水样变红,再向水样中加入铁粉1.12g时,红色恰好褪去。则:
(1)水样中一定存在的金属离子是。
(2)加入铁粉后发生反应的离子方程式为。
(3)加入铁粉前水样中该金属离子的物质的量浓度为。
(1)我国晋代炼丹家葛洪所著《抱朴子》中记载有“以曾青涂铁,铁赤色如铜”[即:曾青(CuSO4)与铁反应生成铜]。试写出该反应的离子方程式:。
(2)铜器表面有时会生成铜绿[CU2(OH)2CO3],这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物的化学方程式:。
(3)工业上常用铝热反应产生的“铁水”来焊接铁轨,请写出铝热反应的化学方程式:。
从海水中可提取多种化工原料,下面是某化工厂对海水的几项综合利用流程图: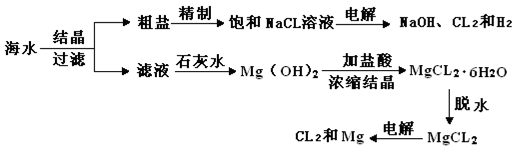
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序中正确的是(填字母)。
| A.①②③④ | B.②③④① | C.②④③① | D.③④②① |
(2)为了降低生产成本,可用海滩上含CaCO3的贝壳制备Ca(OH)2,有关反应的化学方程式为
(3)写出电解饱和NaCl溶液的化学方程式: