氮元素可形成叠氮化物及络合物等。
(1)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-。
①写出与N3-互为等电子体的分子: ,N3-的空间构型是 型。
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:[Co (N3)(NH3)5]SO4、Fe(CN)64-。写出钴原子在基态时的价电子排布式: 。CN-中C原子的杂化类型是 。
(2)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是 (选填序号)
| A.NaN3与KN3结构类似,前者晶格能较小 |
| B.第一电离能(I1):N>P>S |
| C.钠晶胞结构如图,该晶胞分摊2个钠原子 |
| D.氮气常温下很稳定,是因为氮的电负性小 |

(3)对氨基苯酚( )的沸点高于邻氨基苯酚(
)的沸点高于邻氨基苯酚(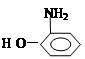 )的沸点(填:“大于”、“小于”、“等于”),理由是
)的沸点(填:“大于”、“小于”、“等于”),理由是
误食亚硝酸钠会造成人畜中毒。亚硝酸钠像食盐一样有咸味,但有很强的毒性。实验证明,它还有很强的氧化性。
(1)已知亚硝酸钠溶液能和氢碘酸发生反应,反应后溶液呈浅黄色,同时产生一种无色气体,该气体遇空气即变为红棕色,请写出反应的化学方程式。
(2)现有两种粉末,一种为亚硝酸钠,另一种为氯化钠,请用两种方法鉴别它们。
为什么由不同种元素的原子生成的PCl5分子为非极性分子,而由同种元素的原子形成的O3分子却是极性分子?
哪些常用仪器标有温度和容量?
哪些仪器使用以前都需检漏?
(1)如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):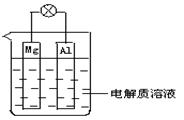
①电解质溶液为稀H2SO4时上述装置中灯泡亮,此时Al电极上发生反应的电极反应式为: ___;
②电解质溶液为NaOH溶液时,灯泡______(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的电极反应式为:_______________;
Al电极上发生反应的电极反应式为:_______________;
b.若灯泡不亮,其理由为:________________________。
(2)原电池原理的应用之一是可以设计原电池。请利用反应“Cu+2Fe3+ =2Fe2+ +Cu2+ ”设制一个原电池(正极材料用碳棒)则该电池的负极材料是,若导线上转移电子1.5 mol,则溶解铜的质量是。另外的重要应用是实验室在用锌与稀硫酸反应制备氢气时,可向溶液中滴加少量硫酸铜溶液。其作用是:。
(3)氢氧燃料电池(电解质为KOH溶液,惰性材料作电极)负极反应的电极反应式为:
。