(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式 ;
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。 漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 ;
(3)在下图的四条直线分别表示钠、铜、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是 ,如果横轴表示消耗掉的硫的质量,则b表示的是四种金属中的 。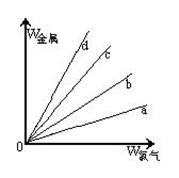
请写出元素周期表中第3横行17纵行的元素,回答下列问题:
⑴该元素的符号是,其原子结构示意图为,属于元素(填“金属”或“非金属”)。
⑵该元素位于元素周期表第周期族,该族的名称为。
⑶请写出该元素的单质与下列物质反应的化学方程式
①水,
②氢氧化钠溶液,
③NaBr溶液,
分子式为C13H16O2惕各酸苯乙酯被广泛用作各类香精的调香剂,当其加入茉莉型或丁香型香精中时,能产生诱人的效果。为了合成该物质,某化工厂实验室的科研人员设计了下列合成线路: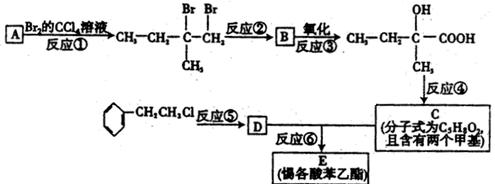
试回答下列问题:
(1)试写出,A的结构简式,B的结构简式。
(2)反应②另加的试剂是,反应④的一般条件是。
(3)试写出生成E的化学方程式:。
(4)上述合成线路中,属于取代反应的有(填编号)。
下列物质(均为中学化学常见物质)转化关系如图所示,已知D为红棕色粉末(反应条件及部分反应物、产物未全部标出).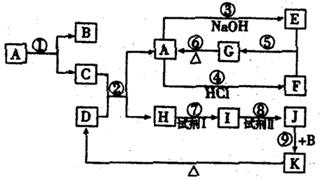
根据图示转化关系填写下列空白:
(1)写出下列物质的化学式:
A:;B:;E:;K:;
(2)C与D的混合物通常叫做(填名称).
(3)写出下列化学反应方程式(注明反应条件,若是离子反应的写离子方程式):
①;
②;
③;
(1)在Fe(OH)3胶体中逐滴加入HI稀溶液,会出现一系列变化:
①先出现红褐色沉淀,原因是:;
②随后沉淀溶解,溶液呈黄色,写出此过程反应的离子方程式:;
③最后溶液颜色加深,原因是:,此过程的离子方程式是:;④如用稀盐酸代替HI稀溶液,能出现上述哪些相同的实验现象:(写序号)。
(2)2.00gC2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,写出该反应燃烧的热化学反应方程式;
已知反应①、②是化工生产中的两个重要反应
①甲溶液 A + B + C
A + B + C
②乙经过粉碎后在沸腾炉中燃烧,得到D和E
其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体。请回答:
(1)A的电子式是。
(2)将A通入B的溶液中,反应的离子方程式是。
(3)1 g C在A中燃烧时放出92.3 kJ的热量,该反应的热化学方程式是。
(4)工业上可利用E为原料冶炼其中所含的金属,方法是。
(5)化工生产②中第二步、第三步用到的设备名称分别为、。第二步采用的反应条件为。
(6)将A和D按物质的量1:1通入下列装置中: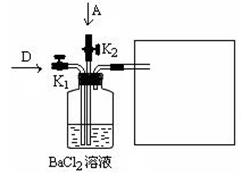
该过程中的化学方程式是:_______________________。
上述实验装置设计不完整,请将所缺部分在装置图的右边方框中画出。
(7)一定条件下,将12 g乙放入过量的的浓硝酸中,反应过程中转移1.5 mol电子,该反应的离子方程式是。