核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域.已知只有质子数或中子数为奇数的原子核有NMR现象.试判断下列哪组原子均可产生NMR现象( )
| A.18O 31P |
| B.元素周期表中ⅢA族所有元素的原子 |
| C.19F 12C |
| D.元素周期表中第三周期元素的所有原子 |
常温下,对下列电解质溶液的有关说法一定正确的是( )
| A.相同浓度和体积的强碱和强酸溶液混合后,溶液的pH=7 |
| B.在NaHCO3溶液中,c(CO32—)>c(HCO3—) |
| C.在有AgCl沉淀的溶液中加入NaCl固体,c(Ag+)减小 |
| D.将pH相等的CH3COONa和Na2CO3溶液稀释相同倍数,CH3COONa溶液的pH较大 |
常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是( )
| A.由水电离产生的c(H+)=10-12 mol/L的溶液中:K+、Na+、ClO-、I- |
B.c(H+)=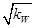 mol/L的溶液中:K+、Fe3+、Cl-、CO32— mol/L的溶液中:K+、Fe3+、Cl-、CO32— |
C.常温下,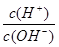 =1×10-12的溶液:K+、AlO2—、CO32—、Na+ =1×10-12的溶液:K+、AlO2—、CO32—、Na+ |
| D.pH=13的溶液中:AlO2—、Cl-、HCO3—、SO42— |
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是( )
①稀释时,溶液中c(OH-)增大
②溶液的pH<7
③溶液中c(Na+)=c(A2-)
④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
| A.①②③④ | B.①③④ | C.①③ | D.②④ |
水中加入下列溶液对水的电离平衡不产生影响的是( )
| A.NaHSO4溶液 | B.KF溶液 | C.KAl(SO4)2溶液 | D.NaI溶液 |
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图8-2(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )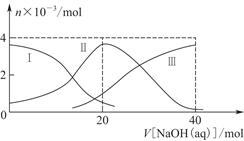
| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A=HA-+H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |