通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。阳离子E是( )
A.可能是Al3+,也可能是Mg2+
B. 只能是Al3+
C.只能是Mg2+
D.以上说法都不对
碘具有升华的性质,利用该性质可用于指纹鉴定,因为
| A.汗液中有AgNO3,可以与碘生成黄色沉淀 |
| B.汗液中有NaCl,可以与碘发生化学反应,有颜色变化 |
| C.根据相似相溶原理,碘易溶于皮肤分泌出的油脂中,有颜色变化 |
| D.根据相似相溶原理,碘与汗液中的淀粉有颜色变化 |
下列化学用语表示正确的是
A.HClO、KOH的结构式都可用X—Y—Z表示
B.O2-、Mg2+的结构中能量最高电子层的轨道表示式都可以用右图表示: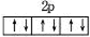
C.甲烷、四氯化碳的分子构型相似,均可以表示为:
D.分子式中n(C)︰n(H)=n:(2n+2)的物质不一定是烷烃
下列诗句、谚语或与化学现象有关,说法不正确的是
| A.“水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化 |
| B.“落汤螃蟹着红袍”肯定发生了化学变化 |
| C.“滴水石穿、绳锯木断”不包含化学变化 |
| D.“看似风平浪静,实则暗流涌动”形象地描述了溶解平衡的状态 |
将质量为w1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐渐加入浓度为amol/L的HCl溶液,反应过程中先有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L.将溶液蒸干灼烧得固体w2g.下列关系式中正确的是
| A.n(Na)+3n(Al)=2V1/22.4 | B.aV2=V1/22.4 |
| C.35.5aV2=w2-w1 | D.35.5aV2>(w2-w1) |
醇中的氧被硫替换称为硫醇。硫醇一般有较强的臭味。如:人的口臭是由于分泌出带臭味的甲硫醇(CH3SH),液化气中添加的报警剂是极臭的乙硫醇(C2H5SH),警察驱散抗议者的臭鼬弹主要成分是丁硫醇(C4H9SH)。下列说法你认为正确的是
| A.在水溶液中,乙硫醇比乙醇更难电离出H+离子 |
| B.乙硫醇在空气中燃烧生成二氧化碳、三氧化硫和水 |
| C.甲硫醇、乙硫醇与丁硫醇互为同系物 |
| D.沸点不同的丁硫醇有四种 |